
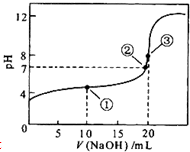
 常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )| A、点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | ||
| B、点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-) | ||
| C、点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
D、在整个滴定过程中:溶液中
|
| c(CH3COOH) |
| c(C3HCOO-)?c(H+) |
| c(CH3COOH) |
| c(C3HCOO-)?c(H+) |
| c(CH3COOH) |
| c(C3HCOO-)?c(H+) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件巳略去).请回答:
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件巳略去).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
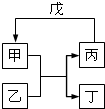 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO2 | H2 |
| ② | Fe | H2O | Fe3O4 | Al |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A、①③ | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙酸和乙醇混合加热制乙酸乙酯 |
| B、苯和浓溴水反应制溴苯 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,FeS的溶解度大于MnS的溶解度 |
| B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol?L-1 |
| C、除去某溶液中的Cu2+,可以选用FeS或MnS作沉淀剂 |
| D、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+和Cl- |
| B、H+和CO32- |
| C、H+和Cl- |
| D、Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=11的溶液中:Na+、[Al(OH)4]-、S2-、SO32- |
| B、水电离的浓度为 10-12mol?L-1的溶液中:Cl-、CO32-、NH4+、SO32- |
| C、使石蕊变红的溶液中:Fe2+、MnO4-、Na+、SO42- |
| D、中性溶液中:Fe3+、Al3+、I-、S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com