
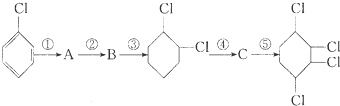
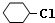 ,B:
,B: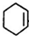 ,C:
,C: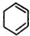 .
.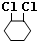 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O、
+2NaCl+2H2O、 +2Cl2→
+2Cl2→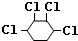 .
. 分析 对比氯苯与1,2-二氯环己烷的结构,可知氯苯与氢气发生加成反应生成A为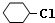 ,A再氢氧化钠醇溶液、加热条件下发生消去反应生成B为
,A再氢氧化钠醇溶液、加热条件下发生消去反应生成B为 ,B与氯气发生加成反应生成1,2-二氯环己烷,对比1,2-二氯环己烷与1,2,3,4-四氯环己烷的结构可知,1,2-二氯环己烷发生消去反应生成C为
,B与氯气发生加成反应生成1,2-二氯环己烷,对比1,2-二氯环己烷与1,2,3,4-四氯环己烷的结构可知,1,2-二氯环己烷发生消去反应生成C为 ,C与氯气在发生加成反应生成1,2,3,4-四氯环己烷,据此解答.
,C与氯气在发生加成反应生成1,2,3,4-四氯环己烷,据此解答.
解答 解:对比氯苯与1,2-二氯环己烷的结构,可知氯苯与氢气发生加成反应生成A为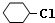 ,A再氢氧化钠醇溶液、加热条件下发生消去反应生成B为
,A再氢氧化钠醇溶液、加热条件下发生消去反应生成B为 ,B与氯气发生加成反应生成1,2-二氯环己烷,对比1,2-二氯环己烷与1,2,3,4-四氯环己烷的结构可知,1,2-二氯环己烷发生消去反应生成C为
,B与氯气发生加成反应生成1,2-二氯环己烷,对比1,2-二氯环己烷与1,2,3,4-四氯环己烷的结构可知,1,2-二氯环己烷发生消去反应生成C为 ,C与氯气在发生加成反应生成1,2,3,4-四氯环己烷.
,C与氯气在发生加成反应生成1,2,3,4-四氯环己烷.
(1)由上述分析可知,A为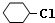 ,B为
,B为 ,C为
,C为 ,故答案为:
,故答案为: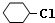 ;
; ;
; ;
;
(2)由上述分析可知,反应①为加成反应,反应②为消去反应,反应③为加成反应,反应④为消去反应,反应⑤为加成反应,
故答案为:加成反应;消去反应;加成反应;消去反应;加成反应;
(3)A→B发生卤代烃的消去反应,反应试剂及条件:氢氧化钠醇溶液、加热,
故答案为:氢氧化钠醇溶液、加热;
(4)反应④的化学方程式为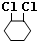 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O,反应⑤的化学方程式为
+2NaCl+2H2O,反应⑤的化学方程式为 +2Cl2→
+2Cl2→ ,
,
故答案为: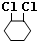 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O;
+2NaCl+2H2O; +2Cl2→
+2Cl2→ .
.
点评 本题考查有机物推断,对比分析转化关系中有机物的结构解答,需要学生熟练掌握官能团的性质与转化,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 在溶液中将MnO4+完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| B | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
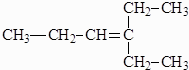 一种有机化合物的结构简式为:
一种有机化合物的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
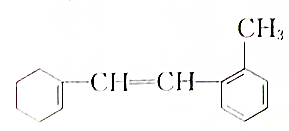 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
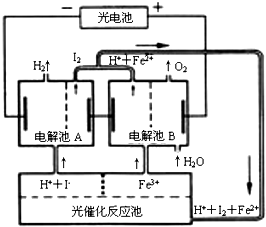
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸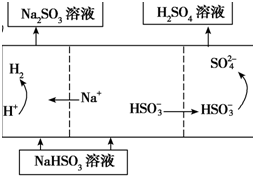 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )| A. | 乙炔 | B. | 乙烷 | C. | 丙炔 | D. | 丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com