
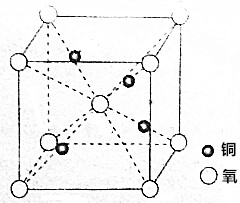
 铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.
铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.分析 根据晶胞的结构图可知,晶胞中含有铜原子数为4,氧原子数为1+8×$\frac{1}{8}$=2,据此确化学式,氧、铜的离子半径分别为anm、bnm,则晶胞中氧、铜原子的体积为=4×$\frac{4}{3}$π(anm)3+2×$\frac{4}{3}$π(bnm)3,根据晶胞的结构图可知,晶胞的体对角线长为4anm+2bnm,所以晶胞的边长为$\frac{4anm+2bnm}{\sqrt{3}}$,则晶胞的体积为($\frac{4anm+2bnm}{\sqrt{3}}$)3,据此计算;
解答 解:根据晶胞的结构图可知,晶胞中含有铜原子数为4,氧原子数为1+8×$\frac{1}{8}$=2,所以该物质的化学式为Cu2O,氧、铜的离子半径分别为anm、bnm,则晶胞中氧、铜原子的体积为=2×$\frac{4}{3}$π(anm)3+4×$\frac{4}{3}$π(bnm)3,根据晶胞的结构图可知,晶胞的体对角线长为4anm+2bnm,所以晶胞的边长为$\frac{4anm+2bnm}{\sqrt{3}}$,则晶胞的体积为($\frac{4anm+2bnm}{\sqrt{3}}$)3,该晶胞的空间利用率为$\frac{2×\frac{4}{3}π(anm)^{3}+4×\frac{4}{3}π(bnm)^{3}}{({\frac{4anm+2bnm}{\sqrt{3}})}^{3}}$×100%=$\frac{\sqrt{3}π({a}^{3}+2{b}^{3})}{({3a+b)}^{3}}$×100%,
故答案为:Cu2O;$\frac{\sqrt{3}π({a}^{3}+2{b}^{3})}{({3a+b)}^{3}}$×100%.
点评 本题是对物质结构的考查,主要考查均摊法及晶胞结构的计算等基础知识,正确判断晶体结构是解题的关键,注意立体几何知识在解题中的灵活运用,难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
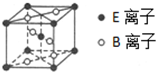 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 | |
| C. | 地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候 | |
| D. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一句 | B. | 第二句 | C. | 第三句 | D. | 第四句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | ① | 420 | ② | 7 | 9 |
| Ⅲ | 探究催化剂对该反应速率的影响 | ③ | 10 | 7 | 9 |
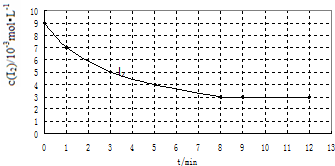
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,4.6gCH3CH2OH中含有 6NA个C-H键 | |
| C. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com