
 ×②-①×
×②-①× ,所以△H=
,所以△H= ×(-571.6KJ/mol)-(-1453kJ/mol)×
×(-571.6KJ/mol)-(-1453kJ/mol)× =-130.9KJ/mol,
=-130.9KJ/mol,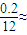 0.017mol,
0.017mol,

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?太原二模)现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.
(2011?太原二模)现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:太原二模 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011届山西省太原市高三模拟(二)(理综)化学部分 题型:填空题
现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因。
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH、H2的燃烧热分别为—726.5kJ/mol、—285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式: 。
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为 ___。溶液中的阴离子向 极定向移动。
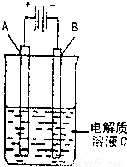
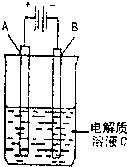
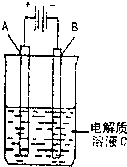
(3)如图是一个电化学装置示意图,用CH3OH—空气燃料电池作此装置的电源。
①如果A为粗铜,B为纯铜,C为CuSO4溶液。该原理的工业生产意义是 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液。通电后,
若B极增重10.8 g,该燃料电池理论上消耗____mol甲醇。(计算结果保留两位有效数字)
(4)常温下向1L、0.2 mol/L NaOH溶液中通入4.48 L(标准状况)的
SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32—)_ c(H2SO3)(填“>”、“<”、或“=”)。有关该溶液中离子浓度关系的判断正确的是 (填字母编号)。
A.c(S O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+) O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+) |
| B.c(H2SO3)+c(HSO3—)+c(SO32—)=" 0.2" mol/L |
| C.c(H2SO3)+c(H+)=c(SO32—)十c(OH-)[来源:学。科。网Z。X。X。K] |
| D.c(Na+)>c(H+)>c(HSO3—)>c(OH—) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com