
 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
分析 (1)a.能与水化合得到碳酸或能与碱反应得到相应的盐与水的氧化物属于酸性氧化物;
b.SO2是导致酸雨发生的主要原因;
c.Na2CO3溶液能与CO2反应转化为碳酸氢钠;
d.氢能源不能同时,用氢能源替代化石燃料可减少CO2排放;
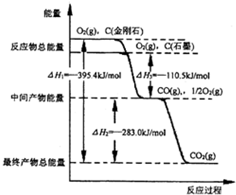
(2)①由图可知石墨能量低于金刚石,能量越高越不稳定;
②由图可知1molCO完全燃烧放出的热量为283kJ;
③1mol石墨不完全燃烧放出的热量为110.5kJ,注明物质的聚集状态与反应热书写热化学方程式;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:2C(s,石墨g)+H2 (g)=C2H2(g);
(4)发生反应:CO(g)+2H2 (g)?CH3OH(g),反应热=反应物总键能-生成物总键能.
解答 解:(1)a.CO2能与水化合得到碳酸,能与碱反应得到相应的盐与水,属于酸性氧化物,故a正确;
b.正常的雨水中溶解二氧化碳,SO2是导致酸雨发生的主要原因,故b错误;
c.Na2CO3溶液能与CO2反应转化为碳酸氢钠,可用Na2CO3溶液捕捉(吸收)CO2,故c正确;
d.氢能源不含碳元素,使用氢能源替代化石燃料可减少CO2排放,故d正确,
故答案为:b;
(2)①由图可知,金刚石能量高于石墨,能量越低越稳定,所以石墨更稳定,故答案为:石墨;
②由图可知1molCO完全燃烧放出的热量为283kJ,CO的燃烧热为283.0kJ•mol-1,故答案为:283.0;
③1mol石墨不完全燃烧放出的热量为110.5kJ,石墨不完全燃烧生成CO的热化学方程式为:C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1,
故答案为:C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:2C(s,石墨g)+H2 (g)=C2H2(g),所以△H=2×(-393.5kJ•mol-1)+$\frac{1}{2}$×(-571.6kJ•mol-1)-$\frac{1}{2}$×(-2599kJ•mol-1)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1;
(4)发生反应:CO(g)+2H2 (g)?CH3OH(g),则△H=1072kJ/mol+2×436kJ/mol-3×413kJ/mol-358kJ/mol-463kJ/mol=-116kJ/mol,
故答案为:CO(g)+2H2 (g)?CH3OH(g)△H=-116kJ/mol.
点评 本题考查化学反应中能量变化、反应热计算与热化学方程式书写等,难度中等,掌握反应热常用计算方法.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、H+、NO3-、SO32- | B. | CO32-、Cl-、Fe2+、NH4+- | ||
| C. | Cu2+、Cl-、SO42-、K+ | D. | Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
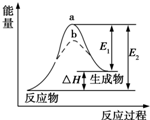
| A. | 如图可知a一定使用了催化剂 | |
| B. | 该反应为放热反应,△H=E1-E2 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 使用催化剂,可降低该反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为放热反应 | B. | 加催化剂能降低该反应焓变 | ||
| C. | A-B的键能为bkJ•mol-1 | D. | 该反应的反应热为△H=(a-b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸性氧化物 | 酸 | 盐 | 混合物 | 电解质 | |
| A | 干冰 | CH3COOH | 烧碱 | (NH4)2SO4•FeSO4•6H2O | C2H5OH |
| B | Al2O3 | HNO3 | NaHSO4 | 氯水 | Cu |
| C | P2O5 | HClO | 纯碱 | 铝土矿 | H2O |
| D | NO | Fe(OH)3 | CaCO3 | 浓盐酸 | NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 工业上用焦炭在高温下还原二氧化硅可制得粗硅 | |
| C. | 高炉炼铁的主要反应是高温下焦炭和氧化铁直接作用炼出铁 | |
| D. | 不通过化学变化就可以从海水中提取溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | Al(OH)3和AlO2 | D. | AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
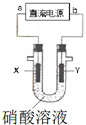 某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )| A. | a极为负极,b极为正极 | |
| B. | 电解时,Y极附近溶液pH降低 | |
| C. | 相同条件下,阴阳两极气体体积比是2:1 | |
| D. | X极的电极反应式是:2H++NO3-+e-═NO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com