
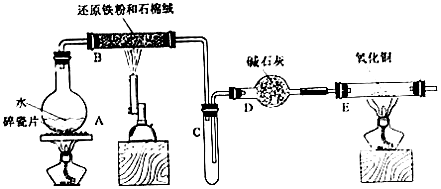
| ²½Öč | ²Ł×÷ | ¼××éĻÖĻó | ŅŅ×éĻÖĻó | |
| 1 | Č”ŗŚÉ«·ŪÄ©¼ÓČėĻ”ŃĪĖį | Āå½ā£¬ĪŽĘųÅŻ | Čܽā£¬ĪŽĘųÅŻ | |
| 2 | ȔɣÖč1ÖŠČÜŅŗ£¬µĪ¼ÓĖįŠŌKMnO4ČÜŅŗ | ×ĻÉ«ĶŹČ„ | ×ĻÉ«ĶŹČ„ | |
| 3 | Č”²½Öč1ÖŠČÜŅŗ£¬µĪ¼ÓKSCNČÜŅŗ | ±äŗģ | ĪŽĻÖĻó | |
| 4 | Ļņ²½Öč3ČÜŅŗÖŠµĪ¼ÓŠĀÖĘĀČĖ® | ŗģÉ«ĶŹČ„ | Ļȱäŗģ£¬ŗóĶŹÉ« | |
·ÖĪö AĢį¹©Ė®ÕōĘų£¬BÖŠĖ®ÕōĘųÓėĢś·¢Éś·“Ó¦3Fe+4H2O£Øg£©$\frac{\underline{\;\;”÷\;\;}}{\;}$4H2+Fe3O4£¬CĪŖĒāĘųµÄŹÕ¼Æ×°ÖĆ£¬DĪŖøÉŌļ×°ÖĆ£¬EÖŠĒāĘųÓėŃõ»ÆĶ·“Ӧɜ³ÉĶŗĶĖ®£¬
£Ø1£©¼ÓČČ“æŅŗĢåÓ¦·ĄÖ¹±©·Š£¬ĢśÓėĖ®ÕōĘų·“Ӧɜ³ÉĖÄŃõ»ÆČżĢśŗĶĒāĘų£»
£Ø2£©ĒāĘųŌŚµćČ¼Ź±Ó¦ĻČŃé“棬ĒāĘųÓėŃõ»ÆĶ·¢ÉśÖĆ»»·“Ó¦£»
£Ø3£©ŅŅ×é¼ÓČėŃĪĖįŗó£¬ŌŚ¼ÓČėKSCN²»±äŗģ£¬ĖµĆ÷²»ŗ¬ĢśĄė×Ó£»¼××é¼ÓČėŃĪĖįČܽāŗ󣬷ֱš¼ÓČėKSCN±äŗģ£¬ĖµĆ÷ŗ¬ÓŠĢśĄė×Ó£¬¼ÓČėøßĆĢĖį¼ŲĶŹÉ«£¬ĖµĆ÷ŗ¬ÓŠŃĒĢśĄė×Ó£»Į½×鏵ŃéµĪ¼ÓĀČĖ®£¬¶¼³öĻÖŗģÉ«ĶŹČ„£¬æÉĖµĆ÷ĀČĘųŃõ»ÆSCN-£»
£Ø4£©ŅņŃõ»ÆŠŌFe3+£¾Cu2+£¬Ōņ¼ÓČėĢś·Ū£¬ĻČ·¢ÉśFe+Fe2 £ØSO4£©3=3FeSO4£¬5.2g¹ĢĢå³ĮµķĪļŅ»¶ØÓŠĶ£¬Ōņŗó·¢ÉśFe+CuSO4=FeSO4+Cu£¬Č»ŗóøł¾Ż»Æѧ·“Ó¦·½³ĢŹ½¼“æɼĘĖć£»øĆ×éĶ¬Ń§ÓÖĻņĒåŅŗÖŠµĪ¼ÓĻ”ĻõĖį£¬¹Ū²ģµ½ÓŠNOĘųĢåÉś³É£¬ĖµĆ÷ĻõĖįŃõ»ÆŃĒĢśĄė×Ó£®
½ā“š ½ā£ŗ£Ø1£©¼ÓČČ“æŅŗĢåŹ±¼ÓČėĖé“Éʬ£¬æÉ·ĄÖ¹±©·Š£¬ĢśÓėĖ®ÕōĘų·“Ӧɜ³ÉĖÄŃõ»ÆČżĢśŗĶĒāĘų£¬·½³ĢŹ½ĪŖ3Fe+4H2O£Øg£©$\frac{\underline{\;\;”÷\;\;}}{\;}$4H2+Fe3O4£¬
¹Ź“š°øĪŖ£ŗ·Ą±©·Š£»3Fe+4H2O£Øg£©$\frac{\underline{\;\;”÷\;\;}}{\;}$4H2+Fe3O4£»
£Ø2£©ĒāĘųŌŚµćČ¼Ź±Ó¦ĻČŃé“棬·ĄÖ¹²»“æµÄĒāĘų±¬ÕØ£¬ĒāĘųÓėŃõ»ÆĶ·¢ÉśÖĆ»»·“Ó¦£¬æɹŪ²ģµ½ŗŚÉ«±äĪŖ×ĻŗģÉ«£¬ĒŅŹŌ¹ÜæŚÓŠĖ®ÖéÉś³É£®
¹Ź“š°øĪŖ£ŗŃé“棻ŗŚÉ«±äĪŖ×ĻŗģÉ«£¬ŹŌ¹ÜæŚÓŠĖ®ÖéÉś³É£»
£Ø3£©¢ŁŅŅ×é¼ÓČėŃĪĖįŗó£¬ŌŚ¼ÓČėKSCN²»±äŗģ£¬ĖµĆ÷²»ŗ¬ĢśĄė×Ó£¬ŌņÉś³ÉŗŚÉ«¹ĢĢåĪŖFeO£¬¹Ź“š°øĪŖ£ŗFeO£»
¢Ś¼××é¼ÓČėŃĪĖįČܽāŗ󣬷ֱš¼ÓČėKSCN±äŗģ£¬ĖµĆ÷ŗ¬ÓŠĢśĄė×Ó£¬¼ÓČėøßĆĢĖį¼ŲĶŹÉ«£¬ĖµĆ÷ŗ¬ÓŠŃĒĢśĄė×Ó£¬ĖµĆ÷¼××éÉś³ÉFe3O4£¬¼ÓČėŃĪĖį£¬·¢ÉśFe3O4+8H+=2Fe3++Fe2++4H2O£¬
¹Ź“š°øĪŖ£ŗFe3O4+8H+=2Fe3++Fe2++4H2O£»
¢ŪŅŅ×é²½Öč4¼ÓČėĀČĖ®£¬·¢ÉśCl2+2Fe2+=2Fe3++2Cl-£¬KSCNÓėĢśĄė×Ó·¢ÉśFe3++SCN-=FeSCN2+£¬Į½×鏵ŃéµĪ¼ÓĀČĖ®£¬¶¼³öĻÖŗģÉ«ĶŹČ„£¬æÉĖµĆ÷ĀČĘųŃõ»ÆSCN-£¬ČēŃéÖ¤£¬æɼĢŠųĻņČÜŅŗÖŠµĪČėKSCNČÜŅŗ£¬ČÜŅŗ±äŗģ¼“æÉÖ¤Ć÷£¬
¹Ź“š°øĪŖ£ŗCl2+2Fe2+=2Fe3++2Cl-£¬Fe3++SCN-=FeSCN2+£»ĀČĖ®½«SCN-Ńõ»ÆĘĘ»µĮĖ£»¼ĢŠųĻņČÜŅŗÖŠµĪČėKSCNČÜŅŗ£¬ČÜŅŗ±äŗģ¼“æÉÖ¤Ć÷£»
£Ø4£©ČÜŅŗÖŠŗ¬ÓŠFe2+£ŗ0.5mol•L-1”Į0.2L=0.1mol£¼$\frac{6g}{56g/mol}$£¬
”ą6gĢś·Ū¹żĮ棬Éč·“Ó¦ĻūŗÄĢśµÄĪļÖŹµÄĮæĪŖx£¬Éś³ÉĶµÄĪļÖŹµÄĮæĪŖy£¬
Fe+Fe2 £ØSO4£©3=3FeSO4
1mol 1mol 3mol
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu
1mol 1mol 1mol 1mol
ymol ymol ymol ymol
æɵĆ$\left\{\begin{array}{l}{3x+y=0.1mol}\\{6g-56x+64y=5.2}\end{array}\right.$£¬
½āµĆx=0.02mol”¢y=0.04mol£¬
ŌČÜŅŗÖŠFe2£ØSO4£©3ĪļÖŹµÄĮæÅضČĪŖ$\frac{0.02mol}{0.2L}$=0.1mol/L£¬
øĆ×éĶ¬Ń§ÓÖĻņĒåŅŗÖŠµĪ¼ÓĻ”ĻõĖį£¬¹Ū²ģµ½ÓŠNOĘųĢåÉś³É£¬ĖµĆ÷ĻõĖįŃõ»ÆŃĒĢśĄė×Ó£¬·½³ĢŹ½ĪŖ6FeSO4+8HNO3=2Fe2£ØSO4£©3+2NO”ü+4H2O+2Fe£ØNO3£©3£¬
¹Ź“š°øĪŖ£ŗ0.1mol/L£» 6FeSO4+8HNO3=2Fe2£ØSO4£©3+2NO”ü+4H2O+2Fe£ØNO3£©3£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄŠŌÖŹŹµŃ飬²ąÖŲæ¼²éĢśĄė×Ó”¢ŃĒĢśĄė×ӵļģŃé·½·Ø”¢ŠŌÖŹŹµŃé·½°øµÄÉč¼ĘÓėĘĄ¼Ū£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬ĢāÄæÄѶČÖŠµČ£¬ŹŌĢā×ŪŗĻŠŌ½ĻĒ棬עŅāÕżČ·Ąķ½ā”¢·ÖĪöĢāÖŠŠÅĻ¢£¬ĮŖĻµĖłŃ§µÄÖŖŹ¶½ųŠŠ½ā“š£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
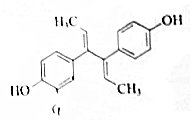 Ė«Ļ©“Ę·ÓŹĒČĖ¹¤ŗĻ³ÉµÄ“Ę¼¤ĖŲ»ÆŗĻĪļ£¬Ęä½į¹¹¼ņŹ½ČēĶ¼£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
Ė«Ļ©“Ę·ÓŹĒČĖ¹¤ŗĻ³ÉµÄ“Ę¼¤ĖŲ»ÆŗĻĪļ£¬Ęä½į¹¹¼ņŹ½ČēĶ¼£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ·Ö×ÓŹ½ĪŖC18H18O2£¬æÉČÜÓŚĀČ·Ā»ņĒāŃõ»ÆÄĘČÜŅŗ | |
| B£® | Ė«Ļ©“Ę·Ó¼ČæÉ·¢Éś¼Ó¾Ū·“Ó¦£¬Ņ²æÉŅŌ·¢ÉśĖõ¾Ū·“Ó¦ | |
| C£® | Ęä±½»·ÉĻµÄ¶žĀČ“śĪļÓŠ7ÖÖ | |
| D£® | 1 molĖ«Ļ©“Ę·ÓøśH2·“Ó¦£¬×ī¶ąæÉĻūŗÄ8mol H2£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
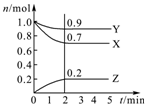 ijĪĀ¶ČŹ±£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ£¬ČżÖÖĘųĢ¬ĪļÖŹX”¢Y”¢ZµÄĪļÖŹµÄĮæ£Øn£©Ėꏱ¼ä£Øt£©±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ÓÉĶ¼ÖŠŹż¾Ż·ÖĪöæÉµĆ£ŗ
ijĪĀ¶ČŹ±£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ£¬ČżÖÖĘųĢ¬ĪļÖŹX”¢Y”¢ZµÄĪļÖŹµÄĮæ£Øn£©Ėꏱ¼ä£Øt£©±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ÓÉĶ¼ÖŠŹż¾Ż·ÖĪöæÉµĆ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾Ū±ūĻ©µÄĮ“½Ś£ŗ-CH2CH£ØCH3£©- | B£® | ŅŅĖįµÄ·Ö×ÓŹ½£ŗCH3COOH | ||
| C£® | ¶ŌĻõ»ł±½·ÓµÄ½į¹¹¼ņŹ½£ŗ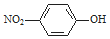 | D£® | H2SµÄµē×ÓŹ½£ŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓƱ„ŗĶŹ³ŃĪĖ®Ģę“śĖ®øśµēŹÆ×÷ÓĆ£¬æÉŅŌÓŠŠ§æŲÖĘ²śÉśŅŅČ²µÄĖŁĀŹ | |
| B£® | ÖĘ·ŹŌķŹ±£¬ŌŚŌķ»ÆŅŗĄļ¼ÓČė±„ŗĶŹ³ŃĪĖ®£¬Äܹ»“Ł½ųøß¼¶Ö¬·¾ĖįÄʵÄĪö³ö | |
| C£® | ÖʱøŅŅĖįŅŅõ„Ź±£¬ĪŖ³żČ„ŅŅĖįŅŅõ„ÖŠµÄŅŅĖį£¬ÓƱ„ŗĶĢ¼ĖįÄĘČÜŅŗŹÕ¼Æ²śĪļ | |
| D£® | ÖĘŅŅĻ©Ź±£¬ÓĆĮæ³ĢĪŖ100”ęµÄĪĀ¶Č¼Ę“śĢęĮæ³ĢĪŖ300”ęµÄĪĀ¶Č¼Ę£¬²ā·“Ó¦ŅŗµÄĪĀ¶Č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ0.1 mol/LµÄĻĀĮŠČÜŅŗ¢ŁNH4Al£ØSO4£©2 ¢ŚNH3•H2O ¢ŪNH4Cl ¢ÜCH3COONH4ÖŠ£¬c£ØNH4+£©Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ł£¾¢Ū£¾¢Ü£¾¢Ś | |
| B£® | ³£ĪĀŹ±£¬pH=4µÄHCOOHČÜŅŗŗĶpH=10µÄ°±Ė®µČĢå»ż»ģŗĻ£»pH=4µÄH2SO4ČÜŅŗŗĶpH=10µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ø÷»ģŗĻČÜŅŗÖŠÓÉĖ®µēĄėµÄc£ØH+£©Ņ»¶Ø²»ĻąµČ | |
| C£® | ³£ĪĀĻĀ0.4mol/L HBČÜŅŗŗĶ0.2mol/L NaOHČÜŅŗµČĢå»ż»ģŗĻŗó£¬Ōņ»ģŗĻŗóČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņŅ»¶ØĪŖ£ŗc£ØB-£©£¾c£ØNa+£©£¾c£ØH+£©£¾c£ØOH-£© | |
| D£® | ³£ĪĀĻĀ0£®lmol/L pHĪŖ4µÄNaHAČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØHA-£©£¾c£ØH+£©£¾c£ØA2-£©£¾c£ØOH-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A | B | C | D |
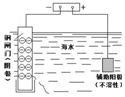
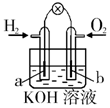
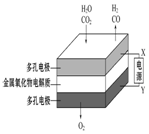
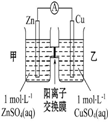
| øÖÕ¢ĆÅČŻŅ×±»øÆŹ“ | a”¢b¾łĪŖ¶čŠŌµē¼«£¬b¼«·“Ó¦ŹĒ£ŗO+4OH--4e-=2H2O | Ņõ”¢ŃōĮ½¼«Éś³ÉµÄĘųĢåµÄĪļÖŹµÄĮæÖ®±ČŹĒ1£ŗ1 | µē³Ų¹¤×÷Ņ»¶ĪŹ±¼ä ŗó£¬ŅŅ³ŲČÜŅŗµÄ×ÜÖŹĮæŌö¼Ó |
 |  |  |  |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com