
| A. | 2015年中国诺贝尔生理学奖获奖者屠呦呦女士用乙醚从黄花蒿中提取青蒿素,该技术应用了分馏原理 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 生物炼铜原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| D. | 近日我国科学家成功制得反应物--超快正电子,正电子与负电子相遇就会湮灭并释放出极大的能量 |
分析 A.用乙醚从黄花蒿中提取青蒿素,利用物质的溶解性;
B.绿色化学的核心是从源头上杜绝污染;
C.微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石;
D.正电子与负电子相遇就会湮灭生成光子.
解答 解:A.用乙醚从黄花蒿中提取青蒿素,为萃取过程,利用物质的溶解性,故A错误;
B.绿色化学的核心是从源头上杜绝污染,而不是对环境进行治理,故B错误;
C.微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,最后转化成可溶的硫酸铜,故C错误;
D.正电子与负电子相遇就会湮灭生成光子,释放出能量,故D正确.
故选D.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇、乙醇、氨气等都是重要的化工原料.
甲醇、乙醇、氨气等都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

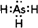 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 | |
| C. | 离子交换膜在工业上应用广泛,如氯碱工业使用阳离子交换膜 | |
| D. | 用氨水法处理燃煤烟气中的二氧化硫,既可以除其污染,又可得到副产品硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
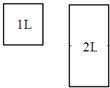
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
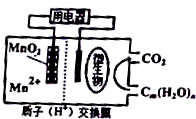
| A. | 在高温下使用更利于微生物发挥作用 | |
| B. | 每生成1molCO2转移4mole- | |
| C. | 放电过程中,质子通过交换膜从左侧移到右侧 | |
| D. | 负极反应式为:Mn2++2H2O-2e-=MnO2+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
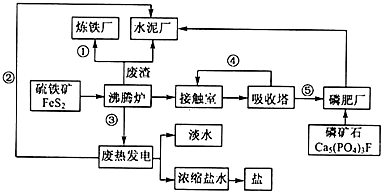
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com