
| A. | NaCl和HCl溶于水都电离成离子 | B. | SiO2和冰块的熔化 | ||
| C. | 晶体硫的熔化和晶体碘的升华 | D. | 酒精和冰醋酸溶于水 |
分析 一般来说,活泼金属和活泼非金属元素之间存在离子键、非金属元素之间存在共价键,分子晶体和原子晶体中存在共价键、离子晶体中存在离子键,分子晶体熔化时破坏分子间作用力、原子晶体熔化时破坏共价键、离子晶体熔化时破坏离子键.
解答 解:A.HCl中含有共价键,溶于水破坏共价键,NaCl含有离子键,溶于水破坏离子键,所以二者不同,故A错误;
B.SiO2的熔化破坏共价键,而冰块的熔化破坏分子间作用力,故B错误;
C.晶体硫的熔化和晶体碘的升华都破坏分子间作用力,故C正确;
D.酒精溶于是分子间作用力的变化和冰醋酸溶于水破坏共价键,所以二者不同,故D错误.
故选C.
点评 本题考查了化学键、晶体类型及熔化时破坏的作用力,根据晶体类型确定熔化时破坏的作用力,题目难度不大.


科目:高中化学 来源: 题型:实验题
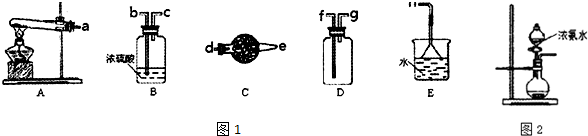
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
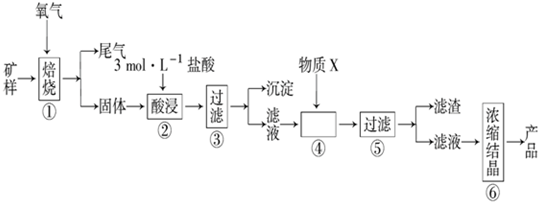
| 金属 离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-142.9 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 2H2+O2=2H2O;△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
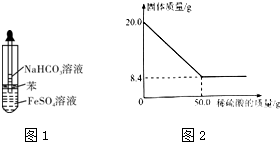
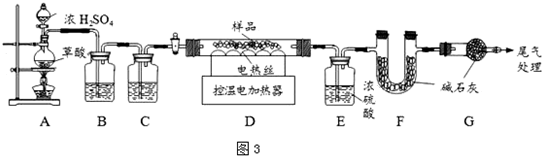
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广碳捕集和储存技术,逐步实现 CO2的零排放 | |
| B. | 乙醇不能用于消毒杀菌 | |
| C. | 用 Na2S 除去工业废水中的 Cu2+离子 | |
| D. | 晶体硅可用于制造太阳能电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com