
| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |
分析 A.使湿润蓝色石蕊试纸变红的气体为酸性气体,应该为红色的石蕊试纸变蓝;
B.能和硝酸银反应产生白色沉淀的可以是硫酸根离子、碳酸根离子或是氯离子;
C.钠性质活泼,与水反应,溶液中不存在金属钠;
D.加人BaCl2溶液时,产生白色沉淀,可能生成氯化银、硫酸钡、碳酸钡等沉淀.
解答 解:A.与NaOH溶液共热,产生使湿润红色的石蕊试纸变蓝的气体,说明原溶液中存在NH4+,而不是使蓝色的石蕊试纸变红,故A错误;
B.某溶液中加入AgNO3 溶液时,产生白色沉淀,说明原溶液中可能存在硫酸根离子、碳酸根离子或是氯离子,应加入硝酸酸化,故B错误;
C.钠性质活泼,与水反应,溶液中不存在金属钠,火焰呈黄色,只能说明含有钠元素,故C错误;
D.加人BaCl2溶液时,产生白色沉淀,可能生成氯化银、硫酸钡、碳酸钡等沉淀,则原溶液中可能存在Ag+或SO42-或CO32-,故D正确.
故选D.
点评 本题考查了常见离子的检验方法判断,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意掌握常见离子的化学性质及检验方法.


科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: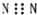 | |
| B. | 甲烷分子的比例模型是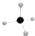 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 在常温常压下,11.2 L Cl2含有的分子数为0.5×6.02×1023 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023 | |
| D. | 标准状况下,11.2 L H2O含有的分子数为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
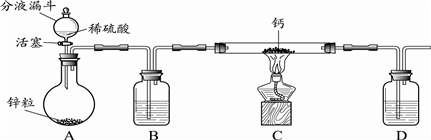
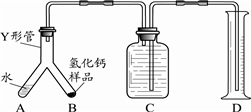
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶于100mL水中 | 配制0.1mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1-2mLFeCl3饱和溶液,搅拌并继续煮沸到变成红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性 |
| D | 用MgCl2、AlCl3溶液做导电性试验 | 证明两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com