
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p 电子数 |
| X | 元素的原子半径是第三周期主族元素中最大的 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
分析 T元素原子的L层上s电子数等于p 电子数,则T元素原子L层s和p电子数都是2,则T是C元素;
X元素的原子半径是第三周期主族元素中最大的,则X是Na元素;
空气中含Y元素单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y是N元素;
Z单质常温、常压下是气体.原子的M层上有1个未成对的p电子,则Z是Cl元素,
(1)这四种元素能形成的常见配体有氢氰根离子、氯离子;
(2)元素的非金属性越强,其电负性越大,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,金属元素的第一电离能小于非金属元素;
(3)元素Q的原子序数是X与Z的原子序数之和,则Q元素原子序数是28,为Ni元素;
①该元素原子核外有28个电子,该元素3d、4s能级上电子为其外围电子;
②元素Ni与元素C、N、Cl分别形成平面型的[Ni(CN)4]2- 和四面体的[NiCl4]2-,Q的配位数为 4,其中Q与 Z 成键时前者价层电子对个数是2个、后者价层电子对个数是4,根据价层电子对互斥理论判断中心原子采用的杂化方式.
解答 解:T元素原子的L层上s电子数等于p 电子数,则T元素原子L层s和p电子数都是2,则T是C元素;
X元素的原子半径是第三周期主族元素中最大的,则X是Na元素;
空气中含Y元素单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y是N元素;
Z单质常温、常压下是气体.原子的M层上有1个未成对的p电子,则Z是Cl元素,
(1)这四种元素能形成的常见配体有CN-、Cl-,故答案为:CN-、Cl-;
(2)元素的非金属性越强,其电负性越大,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,金属元素的第一电离能小于非金属元素,这三种元素非金属性强弱顺序是N>C>Na,则电负性大小顺序是N>C>Na,其第一电离能大小顺序是N>C>Na,
故答案为:N>C>Na;N>C>Na;
(3)元素Q的原子序数是X与Z的原子序数之和,则Q元素原子序数是28,为Ni元素;
①该元素原子核外有28个电子,该元素3d、4s能级上电子为其外围电子,则其外围电子排布式为3d84s2,
故答案为:3d84s2;
②元素Ni与元素C、N、Cl分别形成平面型的[Ni(CN)4]2-和四面体的[NiCl4]2-,Ni的配位数为4,其中T与Y形成的CN-中C原子价层电子对数=1+$\frac{4+1-3}{2}$=2,为sp杂化,Q与Z形成的[NiCl4]2-为四面体结构,则Ni采取sp3杂化,
故答案为:4;sp3.
点评 本题考查物质结构和性质,为高频考点,涉及原子杂化方式判断、元素周期律、原子核外电子排布等知识点,明确价层电子对互斥理论、元素周期律、构造原理等知识点是解本题关键,会正确计算微粒中中心原子价层电子对个数,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.8 mol•L-1 | C. | 1.4 mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和铝 | B. | 锌和铝 | C. | 镁和铝 | D. | 铜和铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况时11.2LO2的质量为32g | B. | 16O的相对原子质量为32 | ||
| C. | 44gCO2和28gCO含有相同的分子数 | D. | 标准状况时44gCO2的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠比碳酸氢钠的热稳定性要好 | |
| B. | 钠在空气中燃烧生成Na2O | |
| C. | 钠在发生化学反应时只作还原剂 | |
| D. | 钠单质暴露在空气中最终将变成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
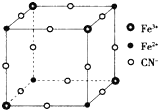 有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )| A. | 该晶体的化学式为MFe2(CN)6 | |
| B. | 该晶体熔融可导电,且属于化学变化 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ②和④ | C. | ②和③ | D. | ③和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的光合作用使得太阳能转化为了化学能 | |
| B. | 燃料燃烧时只是将化学能转化为了热能 | |
| C. | 生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效 | |
| D. | 人类使用照明设备是将电能转化为了光能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com