
多晶硅生产工艺流程如下: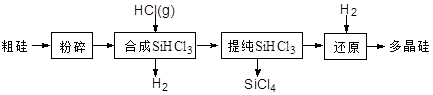
(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)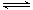 Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
(1)增大接触面积,加快反应速率,充分反应(2分) 蒸馏(2分)
(2)K=  (3分) 升高温度或增大氢气与 SiHC13的物质的量之比或增大氢气浓度(2分)
(3分) 升高温度或增大氢气与 SiHC13的物质的量之比或增大氢气浓度(2分)
(3)HCl、H2(2分)
(4)3SiCl4+Si+2H2=4SiHCl3(2分)
解析试题分析: (1)粗硅粉碎长大了表面积,加快反应速率;SiHCl3和SiCl4均为液态而且互相溶解,根们沸点不同,用蒸馏法分离。
(2)Si为固态,表达式中无Si,使平衡向正反应方向移动,能提高还原时SiHCl3的转化率。
(3))HCl、H2在流程中分别作反应物和生成物,所以可循环使用。
(4)结合流程,对比SiHCl3和SiCl4,可得出反应物还有和H2和Cl2,然后写出化学方程式。
考点:本题考查化学反应速率、化学平衡移动、化学平衡常数、流程图的分析和化学方程式的书写。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:填空题
氨气是生产氮肥、硝酸、纯碱等的重要原料。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
 CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
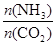 =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。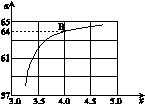
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
| 实验 序号 | 温度/℃ | 时间/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的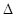 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
| A.减少Fe的量 | B.增加Fe2O3的量 |
| C.升高反应温度 | D.移出部分CO2 |
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
| A.NH3生成的速率与NH3分解的速率相等 |
B.混合气体的反应速率 v正(NH3)=v逆(H2) v正(NH3)=v逆(H2) |
| C.容器内的密度不再变化 |
| D.单位时间内消耗a mol N2,同时生成2a mol NH3 |
 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家一直致力于“人工固氮”的新方法研究。
(1)最新“人工固氮”的研究报道:常温常压.光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O(l)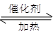 4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q
已知该反应的平衡常数K与温度的关系如右图,则此反应的 Q 0 (填“>”“<”或“=”)。
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
A.容器中气体的平均分子量不随时间而变化 B.v(N2)/ v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水。用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是 (填字母标号)。
A.c(H+)×c(NH3·H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.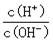
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在右图中画出正(v正).逆(v逆)反应速率随时间t变化的示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是 (选填序号)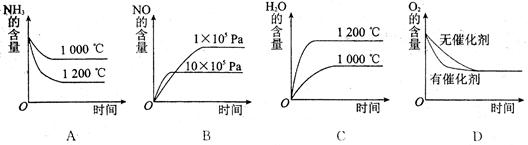
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度(mol/L) 时间(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起 始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | x | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: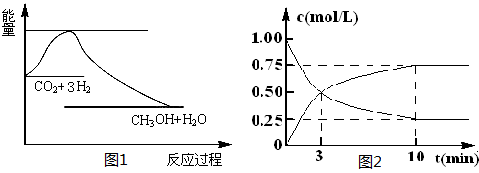
(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。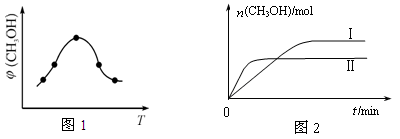
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比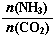 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com