
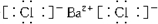 ,③的电子式是
,③的电子式是 .
. 分析 ①BaCl2中只含离子键,②金刚石中只含C-C共价键,③KNO3中含离子键和共价键,④Na2SO4中含离子键和共价键,⑤干冰中只含C=O共价键,⑥碘片中只含I-I非极性键,只有金刚石为原子晶体,金刚石熔点最高,干冰、碘为分子晶体,但干冰熔点最低,以此来解答.
解答 解:①BaCl2中只含离子键,②金刚石中只含C-C共价键,③KNO3中含离子键和共价键,④Na2SO4中含离子键和共价键,⑤干冰中只含C=O共价键,⑥碘片中只含I-I非极性键,
(1)熔化时不需要破坏化学键的是⑤⑥,熔化时需要破坏共价键的是②,熔点最高的是②,熔点最低的是⑤,
故答案为:⑤⑥;②;②;⑤;
(2)属于离子化合物的是①③④,只有离子键的物质是①,晶体以分子间作用力结合的是⑤⑥,故答案为:①③④;①;⑤⑥;
(3)①的电子式是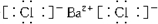 ,③的电电子式为:
,③的电电子式为: ,故答案为:
,故答案为: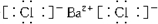 ;
; .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
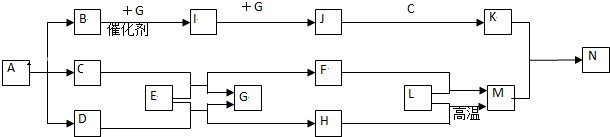
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
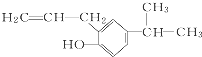 的分子式为C12H16O.
的分子式为C12H16O.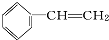 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇. 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有机物
.有机物 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质既有对映异构,也有顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com