
【题目】氮化锂(Li3N)常用作固体电解质和催化剂,遇水蒸气反应生成氢氧化锂和氨气,以一瓶氮气样品(含一氧化碳和氧气)制备纯净的氮化锂,其装置如图所示:
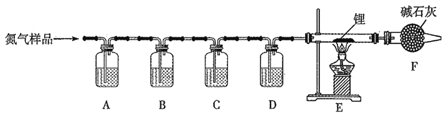
已知:连苯三酚的碱性溶液能吸收少量O2;氯化亚铜的盐酸溶液能吸收少量CO且易被O2氧化。请回答下列问题:
(1)选择下列试剂填入指定位置:
装置代号 | A | B | C | D |
试剂代号 | _____ | ______ | ____ | ____ |
![]() 浓硫酸
浓硫酸 ![]() 氯化亚铜的盐酸溶液
氯化亚铜的盐酸溶液
![]() 连苯三酚的碱性溶液
连苯三酚的碱性溶液 ![]() 氢氧化钠溶液
氢氧化钠溶液
(2)F装置的作用是______________。
(3)实验中,先通入氮气,后点燃酒精灯,目的是_____________。
(4)写出E中反应的化学方程式 ____________。
(5)设计如下装置测定产品纯度:称取a g产品于G烧瓶中,向安全漏斗中加入足量蒸馏水,收集到V mL气体(折合成标准状况)。
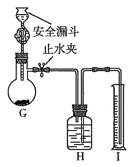
①安全漏斗的作用是______________________。
②H装置所装液体可能是________________![]() 填字母
填字母![]() 。
。
![]() 饱和氯化铵溶液
饱和氯化铵溶液 ![]() 煤油
煤油 ![]() 饱和食盐水
饱和食盐水 ![]() 苯
苯
③根据上述数据计算,该氮化锂产品纯度为___________。
【答案】c b d a 防止空气中的水蒸气和二氧化碳进入E装置 排尽装置内空气,避免空气中水蒸气和二氧化碳与Li反应产生杂质 N2+6Li![]() 2Li3N 起液封作用
2Li3N 起液封作用 ![]()
![]()
【解析】
由实验装置可知,A中连苯三酚碱性溶液能定量吸收O2,B中氯化亚铜盐酸溶液能定量吸收CO,c中NaOH溶液吸收其中的CO2,D中浓硫酸干燥氮气,E中发生N2+6Li![]() 2Li3N,且Li3N遇水蒸气剧烈反应生成氢氧化锂和氨气,F中无水氯化钙或碱石灰可吸收空气中水,防止进气E中,以此来解答。
2Li3N,且Li3N遇水蒸气剧烈反应生成氢氧化锂和氨气,F中无水氯化钙或碱石灰可吸收空气中水,防止进气E中,以此来解答。
(1)由题意可知:A中放连苯三酚的碱性溶液吸收氧气,B中放氯化亚铜的盐酸溶液吸收一氧化碳,C中放氢氧化钠溶液吸收氯化氢,D中放浓硫酸干燥,故合理选项序号分别是c;b;d;a;
(2)F装置用于防止空气中水蒸气和二氧化碳进入E装置,避免水蒸气和二氧化碳与装置内锂或氮化锂反应;
(3)装置内空气中物质能与锂反应实验中,加热前必须排尽空气,所以先通入氮气,后点燃酒精灯,目的是排尽装置内空气,避免空气中水蒸气和二氧化碳与Li反应产生杂质;
(4)在装置E中,锂与氮气化合生成氮化锂,反应方程式为:N2+6Li![]() 2Li3N ;
2Li3N ;
(5)①安全漏斗中加入液体,能起到液封作用,避免气体从漏斗中逸出;
②用排液法收集氨气,说明氨气不溶于该液体,由于氨气极容易溶于水,所以饱和氯化铵溶液、饱和食盐水不能使用,排除选项ac;液体可能是煤油和苯,故合理选项是bd;
③Li3N与H2O反应产生LiOH、NH3,反应方程式为:Li3N+3H2O=3LiOH+NH3,根据方程式可知:n(Li3N)=n(NH3),n(NH3)=![]() =
=![]() mol,所以氮化锂产品纯度为
mol,所以氮化锂产品纯度为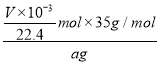 ×100%=
×100%=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】(1)写出方程式:实验室制乙炔__________________;
(2)![]() 该有机物共面的原子最多有_____个,与溴发生加成反应的产物最多有_______种
该有机物共面的原子最多有_____个,与溴发生加成反应的产物最多有_______种
(3)有甲、乙两种物质:
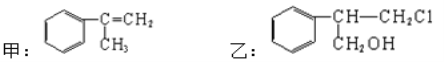
由甲转化为乙需经下列过程(已省略去各步反应的无关产物)
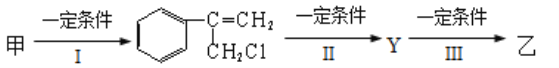
①反应I的反应类型是__________________,
②反应II的条件是_________________________________,
③反应III的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。

回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用____装置(填下图字母代号),如何检验所选装置的气密性_____。
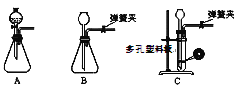
(2)装置2中所盛试剂为_______。
A.NaOH溶液 B.饱和NaHCO3溶液
C.饱和Na2CO3溶液 D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到_____现象时,再点燃酒精灯,这步操作的目的是________。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净____。
②该探究得出钠与二氧化碳反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应,且氯水足量)。
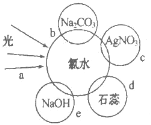
(1)能证明氯水具有漂白性的是___(填“a”“b”“c”或“d”);
(2)c过程中的现象是___;
(3)e过程中的化学方程式为___;
(4)实验室保存饱和氯水的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01mol某气体的质量为0.44g,则该气体的密度为________g·L-1(保留小数点后两位),该气体的相对分子质量为________。
(3)将4g NaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为______;取出10mL此溶液,将此10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
(4)硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色等多种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用Sx表示,对下列蒸气测定的结果是:无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为:______。
(5)把18.0mol/L的浓硫酸稀释成2.00mol/L的稀硫酸100mL,下列操作对所配溶液浓度造成的后果,属于“偏低”的是______________
①未洗涤稀释过浓硫酸的小烧杯;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥;
⑤定容时俯视刻度;
⑥倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法中正确的是
的说法中正确的是
A. 所有原子都可能在同一平面上
B. 最多只可能有9个碳原子在同一平面上
C. 有7个碳原子可能在同一直线上
D. 分子中有5个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空:
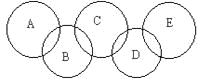
(1)写出下列物质的化学式:A_____,B_____,D_____。
(2)写出下列反应的离子方程式:B+C:_____________________。
(3)相连环物质间发生的反应中,氧化还原反应共有___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中会产生大量含铬废水。需进行无害化处理检测达标后才能排放。
(1) 工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72-还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
写出NaHSO3与Cr2O72-反应的离子方程式:_______________________。
(2) 废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+![]() Cr2O72-
Cr2O72-![]() I2
I2![]() S4O62-。
S4O62-。
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会____(填“偏大”、“偏小”或“不变”)。
②以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点时的现象为________。
③准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 mol·L-1Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com