
【题目】将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O22SO3测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率.
【答案】
(1)
解:
2SO2(g) | + | O2(g) | 2SO3(g) | 物质的量减少△n | |
2 | 1 | 2 | (2+1)﹣2=1 | ||
2mol | 1mol | 2mol | (4mol+2mol)﹣5mol=1mol |
平衡时SO3的浓度为: ![]() =0.5mol/L,氧气浓度为:
=0.5mol/L,氧气浓度为: ![]() =0.25mol/L,二氧化硫浓度为:
=0.25mol/L,二氧化硫浓度为: ![]() =0.5mol/L,
=0.5mol/L,
答:平衡时SO3的浓度为0.5mol/L、氧气浓度为0.25mol/L,二氧化硫浓度为0.5mol/L
(2)
解:平衡时SO2的转化率为: ![]() ×100%=50%,
×100%=50%,
答:平衡时SO2的转化率为50%
【解析】利用差量法求出平衡时参加反应的SO2的物质的量,生成的SO3的物质的量,再利用物质的量浓度、转化率定义计算.
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
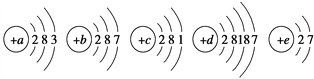
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为: Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4 (s)+2H2O (l)
2PbSO4 (s)+2H2O (l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )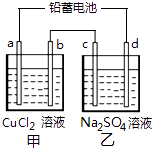
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42﹣(aq)+4e﹣=PbSO4(s)+2H2O(l)
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全反应(假定还原产物只有NO),向反
应后的混合溶液中滴加b mol/LNaOH溶液,当滴加到 V mL时,得到沉淀质量恰好为最
大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)g
B. 恰好溶解后溶液中的NO3-离子的物质的量为bV mol
C. 反应过程中转移电子的物质的量为![]() mol
mol
D. 参加反应硝酸的物质的量为(![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。
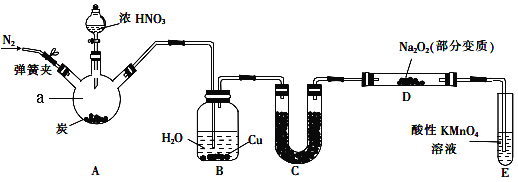
查阅资料可知:
① 2NO+Na2O2![]() 2NaNO2;2NO2+Na2O2
2NaNO2;2NO2+Na2O2![]() 2NaNO3。
2NaNO3。
② NO能被酸性KMnO4氧化成NO3。
(1)装置中仪器a的名称为____________,A中反应的化学方程式是______________________。
(2)装置B中观察到的主要现象是____________________________________________________。
(3)装置C中盛放的试剂是__________________________。
(4)装置E的作用是_______________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是__________________________________。
(6)写出NO被酸性KMnO4氧化的离子反应方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系)。下列说法不正确的是

A. D、E 原子序数之差可能是8、18或32 B. B、C原子序数之差一定是2
C. A、E 原子序数之差可能为2 D. B、D原子序数之差不可能是7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是( )
A.pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO﹣)
B.浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO ﹣)﹣c(CH3COOH)=2[c(H+)﹣c(OH﹣)]
C.醋酸浓溶液加少量水稀释, ![]() 几乎不变
几乎不变
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程与能量的说法中正确的是( )
A.中和反应是吸热反应
B.燃烧属于放热反应
C.化学键断裂放出能量
D.吸热反应中,反应物总能量大于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见表(表中t2>t1):下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
A.反应在t1 min末的速率为v(H2)= ![]() ?mol?L﹣1?min﹣1
?mol?L﹣1?min﹣1
B.平衡时水蒸气的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时水蒸气的转化率为33.33%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com