

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
分析 烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中含有硫酸铵、碳酸铵.
(1)烧渣“酸溶”时,硫酸与氧化铁反应是硫酸铁、FeO与硫酸反应是硫酸亚铁;
(2)烧渣“酸溶”时,二氧化硅不能与硫酸反应;
(3)检验Fe3+常用KSCN溶液,看溶液是否呈血红色;
(4)碳酸亚铁表面会附着硫酸铵,检验最后一次洗涤液中是否含有硫酸根离子判断洗涤是否干净;“沉淀”时,pH过高时溶液中的亚铁离子会转化氢氧化亚铁沉淀,进而生成氢氧化铁;
(5)①“还原”时有硫产生,反应Ⅱ应为Fe3+与FeS2反应生成S与Fe2+;
②由表中数据可知,反应Ⅰ中生成的硫酸根的浓度为0.2mol•L-1,计算出反应Ⅰ中被还原的Fe3+的物质的量,同时计算出生成的亚铁离子的浓度,两个反应中共生成的亚铁离子的浓度为2.4mol•L-1,可求得反应Ⅱ中生成的亚铁离子,进而计算出Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比;
(6)第三次过滤所得到的“滤液”中含有硫酸铵、碳酸铵.
解答 解:烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中含有硫酸铵、碳酸铵.
(1)烧渣“酸溶”时,硫酸与氧化铁反应是硫酸铁、FeO与硫酸反应是硫酸亚铁,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、FeO+H2SO4=FeSO4+H2O,
故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、FeO+H2SO4=FeSO4+H2O;
(2)烧渣“酸溶”时,二氧化硅不能与硫酸反应,第一次过滤所产生的“滤渣”是:SiO2,
故答案为:SiO2;
(3)Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全的试剂为KSCN溶液,
故答案为:KSCN溶液;
(4)碳酸亚铁表面会附着硫酸铵,所以检验FeCO3是否洗净,可以检验洗涤滤液中是否有硫酸根离子,具体方法为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净,
沉淀”时,pH过高时溶液中的亚铁离子会转化氢氧化亚铁沉淀,进而生成氢氧化铁,
故答案为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净;Fe(OH)3;
(5)①“还原”时有硫产生,反应Ⅱ应为Fe3+与FeS2反应生成S与Fe2+,反应离子方程式为:2Fe3++FeS2=3Fe2++2S↓,
故答案为:2Fe3++FeS2=3Fe2++2S↓;
②由表中数据可知,反应Ⅰ中生成的硫酸根的浓度为0.2mol•L-1,据反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+可知,反应Ⅰ中被还原的Fe3+的物质的量浓度为1.4mol•L-1,同时生成的亚铁离子的浓度为1.5mol•L-1,两个反应中共生成的亚铁离子的浓度为2.4mol•L-1,所以反应Ⅱ中生成的亚铁离子浓度为0.9mol•L-1,根据2Fe3++FeS2=3Fe2++2S↓,可知Ⅱ中被还原的Fe3+的物质的量浓度为$\frac{2}{3}$×0.9mol•L-1=0.6mol•L-1,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为1.4mol•L-1:0.6mol•L-1=7:3,
故答案为:7:3;
(6)第三次过滤所得到的“滤液”中含有硫酸铵、碳酸铵,大量存在的离子是:NH4+、CO32-、SO42-,
故答案为:NH4+、CO32-、SO42-.
点评 本题考查物质制备工艺流程,涉及对操作与原理的分析评价、物质的分离提纯、离子检验、化学计算等,需要学生熟练掌握元素化合物知识,(5)中计算为易错点、难点,能较好的考查学生分析计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
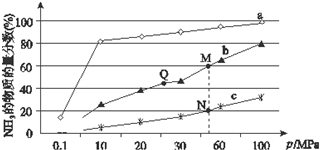 合成氨反应是化学上最重要的反应之一:
合成氨反应是化学上最重要的反应之一:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
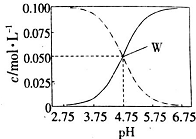 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO)>c(H+)+c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l | |
| D. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com