
| A. | Ag+ H+ NO3- Cl- | B. | Ca2+ NO3- HCO3- Cl- | ||
| C. | K+ H+ Cl- SO42- | D. | Ca2+ Cl-SO42- CO32- |
分析 A.银离子与氯离子反应生成氯化银沉淀;
B.四种离子之间不反应,加入氢离子后生成二氧化碳气体;
C.四种离子之间不反应,但加入氢离子后不会生成气体;
D.钙离子与硫酸根离子、碳酸根离子反应.
解答 解:A.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故A错误;
B.Ca2+、NO3-、HCO3-、Cl-之间不反应,能够共存,加入氢离子后能够生成二氧化碳气体,故B正确;
C.K+、H+、Cl-、SO42-之间不反应,能够共存,但是加入氢离子后不会生成气体,故C错误;
D.Ca2+与SO42-、CO32-之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:填空题
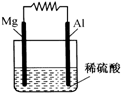 如图所示.
如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
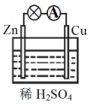
| A. | Zn为负极,Cu为正极 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 正极反应式为Cu-2e-Cu2+ | D. | 原电池的反应本质是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
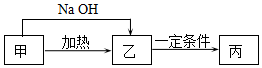 甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.
甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰的主要成分是H2O | B. | SO2可大量用于漂白食品 | ||
| C. | 吸入CO可导致人体中毒 | D. | 小苏打的主要成份是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成 | |
| B. | PH计不能用于酸碱中和滴定终点的判断 | |
| C. | 石油的分馏,煤的干馏、气化、液化均是物理变化 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com