
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
分析 (1)金可制成比纸还薄的金箔是金属的延展性;金属的导热性用铁、铝等做炊具;根据铜的导电性用铜制作印刷电路;
(2)铝是一种活泼金属,具有较强的还原性.
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,称为铝热反应,铁元素的化合价降低,所以氧化铁是氧化剂,而铝元素的化合升高,所以铝是还原剂;
②用铝热反应原理从V2O5冶炼金属钒(V)的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V;
解答 解:(1)金可制成比纸还薄的金箔是金属的延展性;金属的导热性用铁、铝等做炊具;根据铜的导电性用铜制作印刷电路,故答案为:
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
点评 本题考查氧化还原反应方程式的书写、氧化还原反应概念等,难度中等,掌握金属的特性和氧化还原反应中的基本概念就可以迅速解题.


科目:高中化学 来源: 题型:选择题
| A. | 该元素位于元素周期表第三周期表ⅢB族 | |
| B. | 该元素位于s区 | |
| C. | 该元素为金属元素 | |
| D. | 该元素原子M能层共有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸和铁的反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 盐酸和碳酸钙反应:2H++CO32-=H2O+CO2↑ | |
| C. | 硫酸铜和氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | 往氯化铝溶液中滴加过量的氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钛的原子序数为22 | |
| B. | 钛位于元素周期表第四周期 | |
| C. | 钛原子核外电子排布式为1s22s22p63s23p63d4 | |
| D. | 钛属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
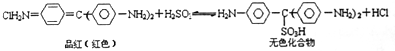
| A. | 品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能在同一平面上 | |
| D. | 无色化合物中的官能团有苯环、磺酸基、氨基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、S2- | D. | Na+、K+、HCO3-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 Ag(s)+Cd2+( aq)═2 Ag+(aq)+Cd(s) | B. | Co2+( aq)+Cd(s)═Co(s)+Cd2+( aq) | ||
| C. | 2 Ag+(aq)+Cd(s)═2Ag(s)+Cd2+( aq) | D. | 2Ag+( aq)+Co( s)═2 Ag(s)+Co2+( aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com