
| A. | 0.1molHCl气体 | B. | 0.1molNa2SO4固体 | ||
| C. | 0.2molNaOH固体 | D. | 0.1mol葡萄糖晶体 |
分析 溶液的导电能力与自由移动离子的浓度成正比,离子浓度越大,溶液的导电能力越强,导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化,NH4Cl是强电解质,加入一物质为非电解质,离子浓度、电荷几乎相同,则导电性变化不大,如果与加入的物质反应生成难电离的物质,则离子浓度减小,导电能力减小,如果不反应的强电解质,导电能力增强.
解答 解:A.NH4Cl为强电解质,通入0.1molHCl气体,HCl为强电解质,两者不反应,氯化氢电离出的氢离子虽抑制铵根离子水解,但溶液中离子浓度增大,导电性增强,故A不选;
B.NH4Cl为强电解质,加入0.1molNa2SO4固体,两者不反应,Na2SO4为强电解质,离子浓度增大,导电性增强,故B不选;
C.0.1molNH4Cl和0.2molNaOH反应生成0.1mol氯化钠和氨气和水,剩余0.1molNaOH,溶质主要为氯化钠、氢氧化钠,离子浓度增大一倍,导电性增强,故C不选;
D.NH4Cl为强电解质,加入0.1mol葡萄糖晶体固体,两者不反应,葡萄糖为非电解质,在溶液中以分子存在,溶液中离子浓度、电荷相同,则导电性基本不变,故D选;
故选D.
点评 本题考查了溶液导电能力强弱的判断,明确溶液的导电性与溶液中自由移动离子浓度成正比是解题的关键,注意非电解质在溶液中以分子存在,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
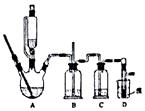 实验室制备1,2-溴乙烷的反应原理如下:
实验室制备1,2-溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度(g/cm3) | 0.79 | 2.2 | 0.71 |
| 沸点(℃) | 78.5 | 132 | 34.6 |
| 熔点(℃) | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
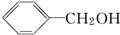 ,B
,B .
. .
. →2
→2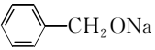 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
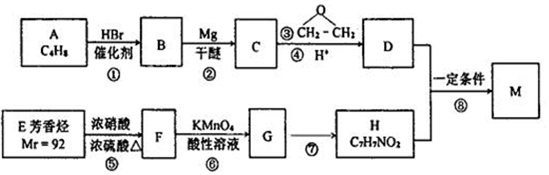
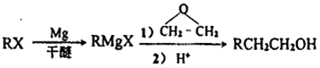
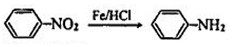 (苯环上的-NH2易被氧化).
(苯环上的-NH2易被氧化).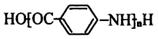 .
.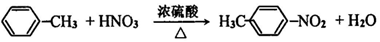 .
. .
. .
.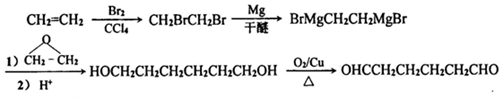 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
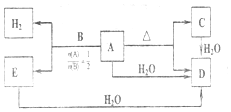
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,C和D反应生成的化合物的电子式是
,C和D反应生成的化合物的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中氮、钠、硅元素均可以游离态形式存在 | |
| B. | 将反应后的固体溶于适量水,静置,通入CO2,无现象 | |
| C. | 微粒的半径:r(K+)>r(Na+)>r(O2-) | |
| D. | 若反应中转移6.02×1022电子,则消耗NaN3的质量为6.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com