
±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺�����û�ѧ��Ӧԭ���о�±��Ԫ�ص��й����ʾ�����Ҫ���塣
��1�����й�����ˮ��������ȷ����_______����д��ţ���
A����ˮ�д������ֵ���ƽ��
B������ˮ��ͨ��SO2����Ư������ǿ
C������ˮ��ͨ��������c( H��)/c(ClO��)��С
D����ˮϡ����ˮ����Һ�е���������Ũ�Ⱦ���С
E����ˮϡ����ˮ��ˮ�ĵ���ƽ��������Ӧ�����ƶ�
F������ˮ�м���������NaOH��������c(Na��)=c(Cl�� )+c(ClO��)
��2����ҵ��ͨ���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ______��
��3�������£���֪25��ʱ�й�����ĵ���ƽ�ⳣ����
д��84����Һ����Ҫ�ɷ�ΪNaClO��¶���ڿ����з�����Ӧ���йػ�ѧ����ʽ________������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᵼ���ж����������ӷ���ʽ�����й�ԭ��___________��
��4�����ٵƾ��бȰ׳���������һ������ܵģ��ص㡣һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ��  ��Ϊģ��������Ӧ��ȷ��ȡ0. 508g�⡢0.736g����������50. 0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ�� WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I��0��t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1����
��Ϊģ��������Ӧ��ȷ��ȡ0. 508g�⡢0.736g����������50. 0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ�� WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I��0��t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1����
�ٸ÷�Ӧ�ġ�H_______0���>����=��<����
�ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2)=_________��
������˵���в���ȷ����_________������ţ���
A�����ø÷�Ӧԭ�������ᴿ��
B���÷�Ӧ��ƽ�ⳣ������ʽ��K=
C����˿�����¶�Խ�ߣ���˿��������WI2Խ�ױ�ΪW�����³�������˿��
��5��25��ʱ����5mL����KCI��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0��1mol/L��AgNO3��Һ�������ɵij�����_________����Һ������Ũ���ɴ�С��˳����_______ [������H����OH����25��ʱ
 ]��
]��
��1��A E F
��2��2Cl-+2H2O 2OH-+Cl2��+H2��
2OH-+Cl2��+H2��
��3��NaClO+CO2+ H2O=HClO+NaHCO3 ; 2HClO 2HCl+O2����ClO-+Cl-+2H+= Cl2��+H2O��
2HCl+O2����ClO-+Cl-+2H+= Cl2��+H2O��
��4���� < �� 0.036/t1mol/(L��min) �� B
��5��AgI c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
���������������1������ˮ�д�������������ʣ�H2O��HClO�����Ƕ������ŵ���ƽ��H2O H++OH-��HClO
H++OH-��HClO H++ClO-����ȷ��B. ����ˮ��ͨ��SO2��������Ӧ��Cl2��SO2��2H2O=H2SO4��2HCl��������H2SO4��HCl��û��Ư���ԡ����Ư�����ü�����C������ˮ��ͨ��������ƽ�⣺Cl2+H2O
H++ClO-����ȷ��B. ����ˮ��ͨ��SO2��������Ӧ��Cl2��SO2��2H2O=H2SO4��2HCl��������H2SO4��HCl��û��Ư���ԡ����Ư�����ü�����C������ˮ��ͨ��������ƽ�⣺Cl2+H2O  H++Cl-+HClO�����ƶ���c(H+) ����HClO
H++Cl-+HClO�����ƶ���c(H+) ����HClO H++ClO-�����ƶ���c(ClO-) ��С��c( H��)/c(ClO��)������D����ˮϡ����ˮ����Һ�е�H+��ClO-��Cl-����Ũ�ȼ�С��������c(H+)��c(OH-)=Kw.����c(OH-)������E����ˮϡ����ˮ������Cl2+H2O
H++ClO-�����ƶ���c(ClO-) ��С��c( H��)/c(ClO��)������D����ˮϡ����ˮ����Һ�е�H+��ClO-��Cl-����Ũ�ȼ�С��������c(H+)��c(OH-)=Kw.����c(OH-)������E����ˮϡ����ˮ������Cl2+H2O  H++Cl-+HClO�����ƶ�������������c(H+) ��С����ˮ���������ü���������ˮ�ĵ���ƽ��������Ӧ�����ƶ�����ȷ��F������ˮ�м���������NaOH��������ӦCl2+NaOH= NaCl+NaClO����ǡ����ȫ��Ӧ����c(Na��)=c(Cl�� )+c(ClO��)����ȷ��������ȷѡ��ΪA��E��F����2���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ2Cl-+2H2O
H++Cl-+HClO�����ƶ�������������c(H+) ��С����ˮ���������ü���������ˮ�ĵ���ƽ��������Ӧ�����ƶ�����ȷ��F������ˮ�м���������NaOH��������ӦCl2+NaOH= NaCl+NaClO����ǡ����ȫ��Ӧ����c(Na��)=c(Cl�� )+c(ClO��)����ȷ��������ȷѡ��ΪA��E��F����2���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ2Cl-+2H2O 2OH-+ Cl2��+H2��.��3���ɵ���ƽ�ⳣ��H2CO3>HClO>HCO3-����֪��H2CO3>HClO�����84����Һ¶���ڿ����з�����Ӧ���йػ�ѧ����ʽNaClO+CO2+ H2O=HClO+NaHCO3��2HClO
2OH-+ Cl2��+H2��.��3���ɵ���ƽ�ⳣ��H2CO3>HClO>HCO3-����֪��H2CO3>HClO�����84����Һ¶���ڿ����з�����Ӧ���йػ�ѧ����ʽNaClO+CO2+ H2O=HClO+NaHCO3��2HClO 2HCl+O2������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᷢ����Ӧ��ClO-+Cl-+2H+= Cl2��+H2O�����ж�������Cl2�����ж�����4������Ϊ�����¶ȣ�WI2��ƽ�⺬�����ͣ�˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ����˦�H <0. �ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2) =v(WI2)= ��c/��t=1.80��10-3mol/0.05L��t1min="0.036/t1mol/(L��min)" .��A. ʹ�ò����ĵ�W��I2������Ӧ��ȡ����WI2������Ӧ�ﵽƽ��������¶ȣ�ƽ�������ƶ������ܲ��������ĵ���W����˿����ø÷�Ӧԭ�������ᴿ�١���ȷ��B. ����W�ǹ��壬Ũ�Ȳ���ı䣬���Ը÷�Ӧ��ƽ�ⳣ������ʽ��
2HCl+O2������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᷢ����Ӧ��ClO-+Cl-+2H+= Cl2��+H2O�����ж�������Cl2�����ж�����4������Ϊ�����¶ȣ�WI2��ƽ�⺬�����ͣ�˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ����˦�H <0. �ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2) =v(WI2)= ��c/��t=1.80��10-3mol/0.05L��t1min="0.036/t1mol/(L��min)" .��A. ʹ�ò����ĵ�W��I2������Ӧ��ȡ����WI2������Ӧ�ﵽƽ��������¶ȣ�ƽ�������ƶ������ܲ��������ĵ���W����˿����ø÷�Ӧԭ�������ᴿ�١���ȷ��B. ����W�ǹ��壬Ũ�Ȳ���ı䣬���Ը÷�Ӧ��ƽ�ⳣ������ʽ��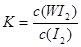 ������C����˿�����¶�Խ�ߣ��ṹƽ���ƶ�ԭ����֪:��˿��������WI2�ͻ������ƶ������������W�����³�������˿�ϡ���ȷ����5������Ksp(AgI)< Ksp(AgI).�������Ȳ����ij���ΪAgI���ڻ��ǰn(K+)=(5mL+5mL)��10-3L/mL��0.1mol/L=0.001mol;n(Ag+)=n(NO3-)=0.006L��0.1mol/L=0.0006mol;n(Cl-)=n(I-)=0.005L��0.1mol/L=0.0005mol;�ڻ����Һ��K+��NO3-�����ģ�������Ӧ��Ag++I-=AgI����Ag++Cl-=AgCl��.�������ĵ��������ʵ�������ȷ����Һ�����ӵ�Ũ�ȴ�С��ϵΪ��c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
������C����˿�����¶�Խ�ߣ��ṹƽ���ƶ�ԭ����֪:��˿��������WI2�ͻ������ƶ������������W�����³�������˿�ϡ���ȷ����5������Ksp(AgI)< Ksp(AgI).�������Ȳ����ij���ΪAgI���ڻ��ǰn(K+)=(5mL+5mL)��10-3L/mL��0.1mol/L=0.001mol;n(Ag+)=n(NO3-)=0.006L��0.1mol/L=0.0006mol;n(Cl-)=n(I-)=0.005L��0.1mol/L=0.0005mol;�ڻ����Һ��K+��NO3-�����ģ�������Ӧ��Ag++I-=AgI����Ag++Cl-=AgCl��.�������ĵ��������ʵ�������ȷ����Һ�����ӵ�Ũ�ȴ�С��ϵΪ��c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
���㣺�������ƽ�⡢�����ܽ�ƽ�⡢��ѧƽ����ƶ�������ƽ�ⳣ���ı���ʽ����ѧ��Ӧ���ʵļ��㡢��Ũ�ȵĴ�С�Ƚϡ���ѧ����ʽ�����ӷ���ʽ����д��֪ʶ��


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������(NaClO2)��һ��ǿ������Ư�����㷺���ڷ�֯��ӡȾ��ʳƷ��ҵ�����ڼ��Ի������ȶ����ڡ���ҵ�������NaClO2����Ҫ�������£�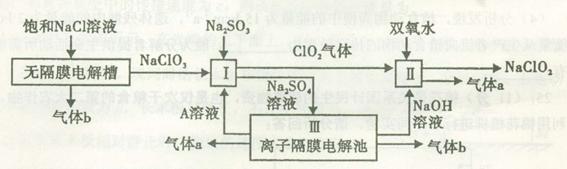
��1��A�Ļ�ѧʽ�� ��װ��III��A�� ����������
��2��II�з�Ӧ�����ӷ���ʽ�� ��
��3��ͨ����ǰ������III�������ӵķ����Ͳ����� ��
��4��Ϊ��ֹII���Ʊ���NaClO2����ԭ��NaCl��Ӧѡ���ʵĻ�ԭ������˫��ˮ�⣬������ѡ��Ļ�ԭ���� (����ĸ���)��
a��Na2O2 b��FeCl2 c��Na2S
��5������ʱ��HClO2�ĵ���ƽ�ⳣ��Ka=1��07 10-2mol��L-1��II�з�Ӧ����NaClO2��Һ(������NaOH)��pH=13������Һ��
10-2mol��L-1��II�з�Ӧ����NaClO2��Һ(������NaOH)��pH=13������Һ��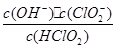 = ��
= ��
��6������a��b������������Һ�ɹ���ȼ�ϵ�أ��øõ�ص��200 mL 0��5 mol��L-1��CuSO4��Һ������ͭ3��2 g����ʱ������Һ������Ũ���ɴ�С��˳����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����������ʵ�����ɳ�����չ����Ҫ��������FeS2��ȼ�ղ�����SO2ͨ�����е�ѭ�����չ��̼�����H2SO4��������H2��
��ش��������⣺
��1����֪1 g FeS2��ȫȼ�շų�7.1 kJ������FeS2ȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ________________________________________________________��
��2����ѭ�����չ��̵��ܷ�Ӧ����ʽΪ_____________________________________��
��3���û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������H2��Ŀ����_______________________________________________________��
��4��������H2���ϡ������Ͻ���Ϊ��ظ������ϣ���MH��ʾ����NiO��OH����Ϊ����������ϣ�KOH��Һ��Ϊ�������Һ�����Ƶø��������������������ء���س�ŵ�ʱ���ܷ�ӦΪ��
NiO��OH����MH Ni��OH��2��M
Ni��OH��2��M
�ٵ�طŵ�ʱ�������ĵ缫��ӦʽΪ______________________________��
�ڳ�����ʱ��Ni��OH��2ȫ��ת��ΪNiO��OH������������罫��һ���缫����O2��O2��ɢ����һ���缫�����缫��Ӧ�����ģ��Ӷ�������������������ر�ը����ʱ�������ĵ缫��ӦʽΪ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��______________________________________________________________��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��____________________________________________________��
��3������Һ����SO2�Ĺ����У�pH��n(SO32-)��n(HSO3-)�仯��ϵ���±���
| n(SO32-)��n(HSO3-) | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
 HSO3-��OH��ˮ��ƽ�����ʵ��________(�����)��
HSO3-��OH��ˮ��ƽ�����ʵ��________(�����)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Na2S2O3��5H2O �׳ơ�������,�dz��õ�����������Ӱ���ͻ�ԭ��;������ɫ������ˮ�ľ���,�������Ҵ�,��20 �� ��70 �� ʱ���ܽ�ȷֱ�Ϊ60.0 g��212 g,Na2S2O3��5H2O��40��45 ���ۻ�,48 ��ֽ⡣������ʵ�����Ʊ����������ʵ�顣
�Ʊ������ķ�Ӧԭ��:Na2SO3+S Na2S2O3
Na2S2O3
�Ʊ�����������:
(1)ʵ�鿪ʼʱ��1 mL�Ҵ���ʪ��۵�����������������
A.������������������ǵij�ֽӴ�
B.��ֹ���������ܽ�
C.������Һ��pH
D.��߲�Ʒ�Ĵ���
(2)���ȹ��˵�ԭ���� ����
(3)��Һ������ֱ�������ᾧ�Ŀ���ԭ���� ����
(4)���˹�������Ҫϴ�Ӳ�Ʒ����,����Һ�����ʺϵ�������������
A.��ˮ�Ҵ� B.����NaCl��Һ C.ˮ D.��Һ
(5)��Ʒ�Ĵ��Ȳⶨ:ȡ���ò�Ʒ10.0 g,���500 mL��Һ,�ٴ���ȡ��25 mL��Һ����ƿ��,�μӼ��ε�����ָʾ��,Ȼ����0.050 mol/L�ı���ˮ��Һ�ζ�,�ظ�����,ƽ������20 mL����ˮ,�漰�ĵζ���Ӧ����ʽΪ:I2+2Na2S2O3 2NaI+Na2S4O6����Ʒ�е�Na2S2O3��5H2O�Ĵ���Ϊ��������%��
2NaI+Na2S4O6����Ʒ�е�Na2S2O3��5H2O�Ĵ���Ϊ��������%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���������е�+4�����������ԣ����л�ԭ�ԡ������Լ�����ˮ��Na2S��Һ�� Na2SO3��Һ��ϡ���ᡢNaOH��Һ����ˮ��
(1)Ҫ֤��Na2SO3���л�ԭ�ԣ�Ӧѡ�õ��Լ��Уߣߣߣߣߣ������������ǣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
��Ӧ�����ӷ���ʽΪ���ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
(2)Ҫ֤��Na2SO3���������ԣ�Ӧѡ�õ��Լ��Уߣߣߣߣߣ������������ǣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
��Ӧ�����ӷ���ʽΪ���ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
NOx������β���е���Ҫ��Ⱦ��֮һ��
(1)NOx���γ����꣬д��NO2ת��ΪHNO3�Ļ�ѧ����ʽ��_____________��
(2)������β��ϵͳ��װ�ô�ת����������Ч����NOx���ŷš�
�ٵ�β���п�������ʱ��NOx�ڴ�ת�����б���ԭ��N2�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ��_______________________________________��
�ڵ�β���п�������ʱ����ת�����еĽ�������������NOx�����Ρ�����������˳�����£�12MgO<20CaO<38SrO<56BaO��ԭ����_______________��
Ԫ�صĽ���������ǿ�������������NOx��������������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������һ�ֳ��õĻ��ʣ��乤ҵ������������ͼ����ش��������⡣
��д����Ӧ����B�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��������C��ͨ�������Ŀ���� ��C��D������Ӧ�����з����ķ�Ӧ������������ԭ��Ӧ���� ���Ӧ�������ţ���
��Ũ����һ�㱣������ɫ�Լ�ƿ������������������û�ѧ����ʽ����ԭ�� ��
�Ƚ���ͭ��ϡ���ᷴӦ�����ӷ���ʽ�� ���÷�Ӧ��ϡ������ֵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��ij��ѧ��ȤС���ͬѧ����Cl2��NH3���Ʊ������ʼ����ʵ������̺Ͳ���װ�����£�
������A��Gװ�����һ����ʵ����֤Cl2��Fe3����I2��������ǿ��ΪCl2>Fe3��>I2(ʵ���в��ϵ�С����Gװ���е��Թ�)��A�з�Ӧ����KMnO4��Ũ���ᣬ��д��A�з�����Ӧ�Ļ�ѧ����ʽ�� ����д���Լ�MΪ ��Һ��֤��������ΪCl2>Fe3��>I2��ʵ�������� ��
����֪3Cl2��2NH3=6HCl��N2����D����ƿ�г�������ɫ����ر�a��c��b��D�е�����Ϊ����ɫ������ʧ���������̣���Ӧһ��ʱ��ر�b��c���۲쵽������Ϊ_________________________________________________________________��
��2��ij��ˮ�к���һ������Na+��SO �����ܺ���CO
�����ܺ���CO ��ij�о�С�����ⶨ����SO
��ij�о�С�����ⶨ����SO ��Ũ�ȣ��������ʵ�鷽����
��Ũ�ȣ��������ʵ�鷽����
�ٴ������Լ���ѡ���Լ�XΪ_________������ţ���
A��0.1 mol/L KMnO4(H2SO4�ữ)��Һ B��0.5 mol/L NaOH��Һ
C��������ˮ D��KI��Һ
�ڼ����Լ�X����SO �����ӷ���ʽΪ_____________________________________��
�����ӷ���ʽΪ_____________________________________��
��֤���÷�ˮ���Ƿ���CO ��ʵ�鷽��Ϊ ��
��ʵ�鷽��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com