
| A. | 1 L 0.1 mol•L-1的乙醇溶液中分子总数为0.1NA | |
| B. | 常温常压下,28 g乙烯含有的电子数为16NA | |
| C. | 44g乙酸乙酯和丁酸的混合物中共含有碳原子数为2 NA | |
| D. | m g丙烯和戊烯的混合物中共用电子对数为$\frac{3m}{14}$NA |
分析 A、乙醇溶液中除了乙醇分子外,还含水分子;
B、求出乙烯的物质的量,然后根据乙烯中含16个电子来分析;
C、乙酸乙酯和丁酸的化学式均为C4H8O2;
D、丙烯和戊烯的最简式均为CH2,且1molCH2中含3mol共用电子对.
解答 解:A、乙醇溶液中除了乙醇分子外,还含水分子,故溶液中的分子个数多于0.1NA个,故A错误;
B、28g乙烯的物质的量为1mol,而乙烯中含16个电子,故1mol乙烯中含16NA个电子,故B正确;
C、乙酸乙酯和丁酸的化学式均为C4H8O2,故44g混合物总含有的C4H8O2的物质的量为n=0.5mol,故含有2mol碳原子即2NA个,故C正确;
D、丙烯和戊烯的最简式均为CH2,故mg混合物中含有的CH2的物质的量为n=$\frac{m}{14}$mol,且1molCH2中含3mol共用电子对,故含有的共用电子对为$\frac{3m}{14}$NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )| A. | CuCl2 | B. | AlCl3 | C. | H2O2 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2 与过量乙烷在光照下反应,生成的有机物中含有氯原子的总数为2NA | |
| B. | 1molC3H8 中含有的共用电子对数为11NA | |
| C. | 1.5g 甲基含有的质子数和电子数之和为1.8NA | |
| D. | 标况下,11.2 L癸烷含有的原子个数为16 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: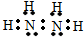 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
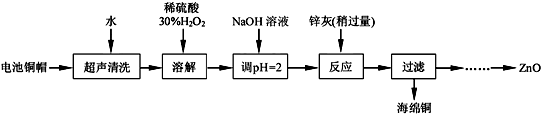
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com