
美丽中国,节约为荣.“开源节流”是应对能源危机的重要举措.请回答下列问题:
(1)下列做法不利于能源“开源节流”的是b(填序号).
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少煤、石油等化石燃料的使用
d.减少资源消耗,增加资源的重复使用,注重资源的循环再生
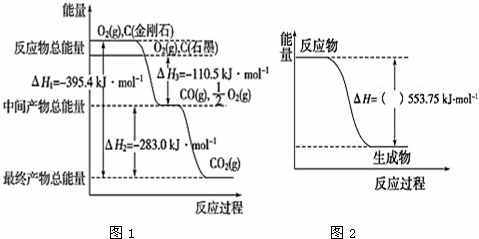
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应放出的热量如图1所示:
①在通常状况下,石墨(填“金刚石”或“石墨”)更稳定,石墨的燃烧热△H= .
②又已知:2H2(g)+O2(g)═2H2O(l)△H2=﹣571.6kJ•mol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=﹣2599.2kJ•mol﹣1根据盖斯定律及以上信息,写出C(石墨)与H2(g)反应生成1molC2H2(g)的热化学方程式: .
(3)丙烷(C3H8)是一种优良的气体燃料.试回答下列问题:
①如图2是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图(图中括号内“+”或“﹣”未标注),写出表示丙烷燃烧热的热化学方程式: .
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔,1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量,若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 .
考点: 常见的生活环境的污染及治理;热化学方程式;有关混合物反应的计算.
分析: (1)a.沼气是可再生能源;
b.煤、石油、天然气属于不可再生资源;
c.太阳能、水能、风能、地热等取之不尽、用之不竭,可代替不可再生的化石燃料;
d.减少资源消耗,增加资源的重复使用,符合“开源节流”;
(2)①物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
②依据盖斯定律将热化学方程式变性解答;
(3)①分析图象得到生成1mol水的焓变△H=﹣553.75KJ/mol;依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
②依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比.
解答: 解:(1)a.沼气是可再生能源,故在农村地区开发沼气能源,符合开源节流的思想,故a不选;
b.煤、石油、天然气属于不可再生资源,大力开采煤、石油和天然气,不符合节源开流的思想,故b选;
c.太阳能、水能、风能、地热等取之不尽、用之不竭,代替不可再生的化石燃料符合开源节流的思想,故C不选;
d.减少资源消耗,增加资源的重复使用,符合开源节流思想,故d不选;
故选:b;
(2)①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=﹣393.5kJ▪mol﹣1;
故答案为:石墨;﹣393.5kJ▪mol﹣1;
②:①C (s,石墨)+O2(g)=CO2(g)△H1=﹣393.5kJ•mol﹣1;
②2H2(g)+O2(g)=2H2O (l)△H2=﹣571.6kJ•mol﹣1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=﹣2599.2kJ•mol﹣1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×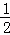 ﹣③×
﹣③×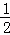 得到,2C(石墨,s)+H2(g)C2H2(g),△H=+226.8kJ/mol;
得到,2C(石墨,s)+H2(g)C2H2(g),△H=+226.8kJ/mol;
故答案为:2C(石墨,s)+H2(g)C2H2(g),△H=+226.8kJ/mol;
(3)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=﹣553.75KJ/mol,1mol丙烷完全燃烧生成3mol二氧化碳和4mol水,则写出的热化学方程式为:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=﹣2215.0 kJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=﹣2215.0 kJ/mol;
②1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1﹣x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=﹣2215.0 kJ/mol,得到丙烷燃烧放热(1﹣x)2215KJ;依据条件得到:1645KJ﹣1455xKJ=(1﹣x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3,
故答案为:1:3.
点评: 本题为综合题,考查了新能源的开发与利用,热化学方程式书写,反应热相关计算,明确热化学方程式书写注意问题、盖斯定律的使用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:
氢化钙(CaH2中H为﹣1价)可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,下列说法错误的是( )
|
| A. | CaH2既是氧化剂,又是还原剂 |
|
| B. | H2既是氧化产物,又是还原产物 |
|
| C. | CaH2是还原剂,H2O是氧化剂 |
|
| D. | 氧化产物与还原产物的质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质是由3种氨基酸分子脱水缩合生成的四肽的结构简式:
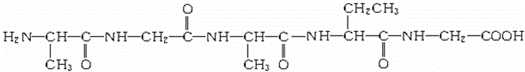
这种四肽彻底水解时,不可能产生的氨基酸是()
A. 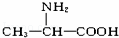 B.
B. 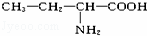 C. NH2﹣CH2﹣COOH D.
C. NH2﹣CH2﹣COOH D. 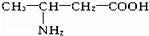
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物中当某一碳原子同时连在两个﹣OH是一种不稳定结构,会自动转化为稳定结构,例如: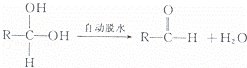
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生下列反应:
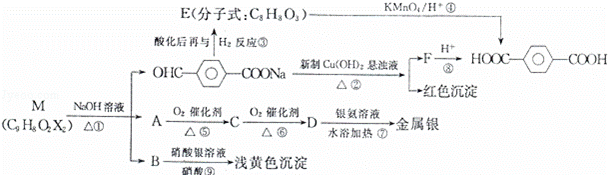
试回答下列问题:
(1)X为Br(填元素符号);反应①的反应类型是 .
(2)写出M的结构简式: .
(3)写出由A→C的化学反应方程式: .
(4)写出与E互为同分异构体,且同时符合下列四个条件的有机物的结构简式: 、 .
①含酯基;②含酚羟基;③不能发生银镜反应;④苯环上的一氯取代物只有2种.
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m﹣n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是()
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1:2
B. Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. Y分别与Z、W、R以两种元素组成的常见化合物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是()
A. 硫酸铝溶液中加入过量氨水 Al3++3OH﹣═Al(OH)3↓
B. 电解饱和食盐水 2Cl﹣+2H2O  H2↑+C12↑+2OH﹣
H2↑+C12↑+2OH﹣
C. 碳酸钙与醋酸反应 CaCO3+2H+═Ca2++CO2↑+H2O
D. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中存在较多的H+、SO42﹣、NO3﹣,则该溶液中还可能大量存在的离子组是()
A. Al3+、CH3COO﹣、Cl﹣ B. Mg2+、Ba2+、Br﹣
C. Mg2+、Cl﹣、I﹣ D. Na+、NH4+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
|
| A. | 铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑ |
|
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓ |
|
| C. | 三氯化铁溶液中加入铁粉Fe3++Fe=2Fe2+ |
|
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com