
A、B、C、D、五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
|


科目:高中化学 来源: 题型:
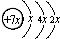 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: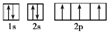

查看答案和解析>>
科目:高中化学 来源: 题型:
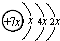 A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: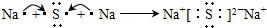
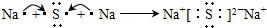
查看答案和解析>>
科目:高中化学 来源: 题型:
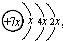 ,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.
,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.查看答案和解析>>
科目:高中化学 来源:2001~2002学年度第二学期形成性练习 题型:021
有a、b、c、d和![]() 五种胶体,若将a与c、b与d、c与d、b与
五种胶体,若将a与c、b与d、c与d、b与![]() 两两混和,均产生凝聚现象.其中胶体微粒带负电荷的溶胶是
两两混和,均产生凝聚现象.其中胶体微粒带负电荷的溶胶是
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com