
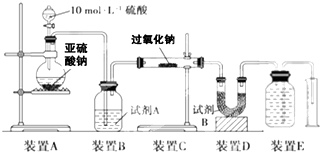
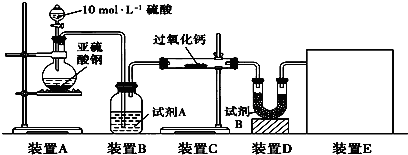
过氧化钙(CaO2)是一种安全无毒物质,带有数量不等的结晶水,通常还含部分CaO。已知:2CaO2·nH2O 2CaO+O2↑+2nH2O,2CaO2+4HCl=2CaCl2+2H2O+O2↑。现称取2.168 g过氧化钙样品分成两等份进行下列实验:
2CaO+O2↑+2nH2O,2CaO2+4HCl=2CaCl2+2H2O+O2↑。现称取2.168 g过氧化钙样品分成两等份进行下列实验:
实验一:将一份过氧化钙样品充分灼热,结果得到的O2在标准状况下体积为134.4 mL。
实验二:将另一份样品溶于适量的稀盐酸中,充分反应后,加入足量的Na2CO3溶液,结果得到1.40 g沉淀。
(1)试计算2.168 g样品中CaO的质量.
(2)试计算样品中CaO2·nH2O的n值。
(1)一份中:n(CaO2·nH2O)=2n(O2)=0.012mol(1分)n(CaCO3)=0.014mol(1分)
n(CaO)=n(CaCO3)- n(CaO2·nH2O)=0.002mol(1分)2.168 g
样品中m(CaO)=0.002mol×56g/ mol×2=0.224 g(2分)
(2)2×0.012×(72+18n)=2.168- 0.224 n=0.5(3分)
【解析】
试题分析:(1)n(O2)=0.1344L/22.4L/mol=0.006mol
一份中:n(CaO2•nH2O)=2n(O2)=0.012mol,n(CaCO3)=0.014mol ,
n(CaO)=n(CaCO3)-n(CaO2•nH2O)=0.002mol,2.168 g样品中m(CaO)=0.002mol×56g/mol×2=0.224g,答:2.168g样品中CaO的质量为0.224g,(2)2.168g过氧化钙样品中的质量为2.168g-0.224g,则2×0.012×(72+18n)=2.168-0.224,n=0.5,答:样品中CaO2•nH2O的n值为0.5.
考点:本题考查化学方程式的计算,题目难度不大,注意根据物质的质量关系结合质量守恒根据方程式计算.


科目:高中化学 来源: 题型:
| 7m1 |
| 30 |
| 7m1 |
| 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
| 5 |
| 2 |
| 5 |
| 2 |
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
| 5 |
| 2 |
| 5 |
| 2 |
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 36cV×10-3 |
| a |
| 36cV×10-3 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:

 CaO2+2HCl
CaO2+2HCl CaO2+2HCl
CaO2+2HCl查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com