
具有单双键交替长链(如:
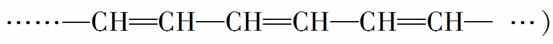 的高分子化合物有可能成为导电塑料。2000年诺贝尔(Nobel)化学奖即授予开辟此领域的3位科学家。下列高分子中可能成为导电塑料的是( )
的高分子化合物有可能成为导电塑料。2000年诺贝尔(Nobel)化学奖即授予开辟此领域的3位科学家。下列高分子中可能成为导电塑料的是( )
A.聚乙烯 B.聚丁二烯
C.聚苯乙烯 D.聚乙炔
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料:

(1)聚合物F的结构简式是_____________________________ ___________________________________________________________________________________________________________________。
(2)D的结构简式是_______________________________ _________________________________________________________________________________________________________________。
(3)B转化为C的化学方程式是____________________________ _________________________________________________________________________________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是___________________ _____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学药品的贮存方法正确的是 ( )
A.新制氯水存放在带玻璃塞的无色细口瓶中
B.镁条保存在细口瓶中密闭保存
C.氢氧化钠固体保存在带橡胶塞的广口瓶中
D.少量金属钠保存在煤油、四氯化碳等有机溶剂中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系正确的是 ( )
A.室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+)
B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+) >c(Cl-) >c(HCO3-) >c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = c(Ba2+)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-) + c(A-) = 2c(H+) + c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
随着有机高分子材料研究的不断加强和深入,使一些重要的功能高分子材料的应用范围不断扩大。下列应用范围是功能高分子材料的最新研究成果的是( )
①新型导电材料 ②仿生高分子材料
③高分子智能材料 ④电磁屏蔽材料
A.①② B.②③
C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物C和E都是医用高分子材料,具有相同的元素百分组成,均可由化合物A制得,如图所示。B和D互为同分异构体。完成下列问题:
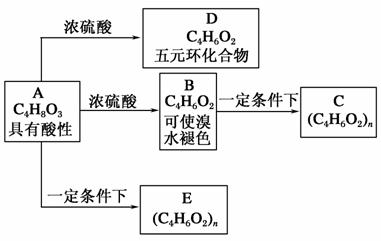
(1)化学方程式:A→D______________________________ __________________________________________;
B→C________________________________________________________________________;
(2)反应类型:A→B______________________________ __________________________________________;
B→C________________________________________________________________________;
A→E________________________________________________________________________;
(3)E的结构简式:________________________________ ________________________________________;
(4)A的同系列同分异构体(分子结构中有支链)
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
既能用浓H2SO4干燥,又可用CaO干燥的气体有
①H2 ②O2 ③N2 ④SO2 ⑤H2S ⑥CH4 ⑦NH3 ⑧CO2
A.①②③⑥ B.①②③⑧
C.④⑤⑥ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。理论上硫酸和硝酸的物质的量之比最佳为:_________________________________。
(2)实际上,即使铜粉、硫酸及硝酸都比较纯,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为_____________________________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
请回答下列问题:已知:Ksp[Cu(OH)2]≈10-22,Ksp[Fe(OH)2]≈10-16,Ksp[Fe(OH)3]≈10-38
①为了使铁元素全部沉淀,应调节pH至少为______________________________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+===4Fe3++2H2O,请写出其第2歩反应的离子方程式_____________________
________________________________________________________________________。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50 ℃~60 ℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50 ℃~60 ℃,温度不宜过高的主要原因是________________________________________________________________________;
⑤写出该反应的化学方程式为__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com