
【题目】25℃,在20 mL 0.1 mol·L-1氨水溶液中逐滴加入0.1 mol·L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是 ( )
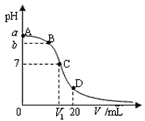
A. 当V=10mL时,溶液中存在: c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-)
B. A、C间任一点,溶液可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. 在C点,V1<10mL,且有 c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D. 在D点,存在:c(NH4+)+c(NH3·H2O)>c(Cl-)
【答案】B
【解析】
A. 当V=10mL时,反应后溶液的溶质为等物质的量的NH4Cl和NH3![]() H2O,根据电荷守恒:c(H+)+c(NH4+)= c(Cl-)+c(OH-),根据物料守恒:c(NH4+)+c(NH3·H2O)=2 c(Cl-),溶液显碱性,说明NH3
H2O,根据电荷守恒:c(H+)+c(NH4+)= c(Cl-)+c(OH-),根据物料守恒:c(NH4+)+c(NH3·H2O)=2 c(Cl-),溶液显碱性,说明NH3![]() H2O的电离大于NH4+的水解,即c(NH3·H2O)<c(Cl-)< c(NH4+),所以c(H+)+c(NH4+)>c(NH3·H2O)+c(OH-),故A错误;
H2O的电离大于NH4+的水解,即c(NH3·H2O)<c(Cl-)< c(NH4+),所以c(H+)+c(NH4+)>c(NH3·H2O)+c(OH-),故A错误;
B.如果溶液中加入HCl的物质的量稍大,则存在c(Cl-)>c(OH-),故B正确;
C.氯化铵是强酸弱碱盐,其溶液呈酸性,要使混合溶液呈中性,则盐酸体积应该稍微小于氨水体积,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)= c(Cl-),溶液中铵根离子水解程度较小,所以离子浓度大小顺序是c(NH4+)=c(Cl-)>c(OH-)=c(H+),故C错误;
D.D点,二者恰好反应生成氯化铵,根据物料守恒得c(NH4+)+c(NH3·H2O)=c(Cl-),故D错误。
答案选B。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 向含0. 1 mol Na2SiO3的溶液中滴加盐酸,生成的H2SiO3胶体中胶粒的数目为0.1NA
B. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
C. 常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10 NA
D. 7.8gNa2O2分别与过量的CO2和过量的SO2充分反应,转移的电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述中正确的是 ( )
A. pH=0的H2SO4溶液与1 mol·L-1 的Ba(OH)2溶液中水的电离程度相同
B. 0.2mol·L-1 CH3COOH溶液中的c(H+)是0.1mol·L-1 CH3COOH中的c(H+)的2倍
C. 室温时,pH=2的CH3COOH和0.01mol·L-1 NaOH溶液等体积混合,混合后pH=7
D. 等物质的量浓度的Na2S和NaHS的混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分別充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为_____。
②T1___(填“>”或“<”)T2,该反应是_____(填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___(填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___(填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成 NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______(列出数学计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下6种说法:
①氯水、氨水、水玻璃、水银都是混合物;
②明矾、冰醋酸、石膏都是电解质;
③氯酸、烧碱、纯碱依次分别为酸、碱、盐;
④![]() H+、
H+、![]() H+、
H+、![]() H+互为同位素;
H+互为同位素;
⑤胶体带电是电泳的前提条件;
⑥生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品。
其中不正确的是
A. ①⑤B. ①④⑤⑥C. ②③④D. ②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com