
【题目】I已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表(单位省略):
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)写出碳酸的第一步电离方程式___。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为___(填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___。
(4)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是___。
a.c(H+)>c(OH-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
Ⅱ.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学用0.1000mol/L的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用___装KMnO4溶液。
②滴定到达终点的现象是___。
③用移液管吸取25.00m试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___mol/L。
【答案】H2CO3 ![]() H++HCO3- ②>①>③ CN-+CO2+H2O=HCO3-+HCN c ③>②>① 酸式滴定管 滴入最后一滴酸性高锰酸钾标准溶液,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色 0.1700
H++HCO3- ②>①>③ CN-+CO2+H2O=HCO3-+HCN c ③>②>① 酸式滴定管 滴入最后一滴酸性高锰酸钾标准溶液,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色 0.1700
【解析】
(1)碳酸的第一步电离方程式为H2CO3 ![]() H++HCO3-;
H++HCO3-;
(2)25℃时,因为醋酸、碳酸氢根、氢氰酸的电离平衡常数分别为1.7×10-5、5.6×10-11、6.2×10-10,所以等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,其水解程度由大到小气顺序为②>①>③;
(3)25℃时,由于氢氰酸的电离平衡常数介于碳酸的一级电离和二级电离之间,所以,向NaCN溶液中通入少量CO2只能生成碳酸氢根;
(4)将浓度为0.02mol/L的HCN与0.01mol/L NaOH溶液等体积混合,得到浓度均为0.005 mol/L的HCN和 NaCN混合溶液,溶液中c(Na+)>c(CN-),则根据电荷守恒可知c(OH-)>c(H+),说明NaCN的水解作用大于HCN的电离作用。a.c(H+)>c(OH-),错误;b.由电荷守恒和物料守恒可得,2c(H+)+c(HCN)=2c(OH-)+ c(CN-),b错误;c.由物料守恒可知,c(HCN)+c(CN-)=0.01mol/L,c正确;
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,其中氯化钠不能水解,NaCN和CH3COONa都能水解且其溶液均显碱性,由于HCN的电离常数更小,故NaCN的水解程度大于CH3COONa,因此,3种溶液中c(H+)由大到小的顺序为③>②>①,3种溶液中的c(Na+)相等,故3种溶液中阳离子的总浓度由大到小的顺序为③>②>①,由电荷守恒可知,阴离子总浓度由大到小的顺序为③>②>①;
(6)①酸性高锰酸钾标准溶液显酸性,所以滴定时0.1mol/L的酸性高锰酸钾标准溶液应用酸式滴定管盛装;
②滴定终点时的现象是滴入最后一滴酸性高锰酸钾标准溶液,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色;
③由于第二次数据误差过大,故舍去,其他三组的平均值为17.00mL,根据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2 ![]() ,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol L-1×0.017L,c(H2O2)=
,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol L-1×0.017L,c(H2O2)= ![]() =0.1700mol/L。
=0.1700mol/L。


科目:高中化学 来源: 题型:
【题目】在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示。容器中发生以下反应:N2+3H2![]() 2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:

(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积仍与上述平衡时完全相同,那么:
①若a=1,c=2,则b=____。在此情况下,反应起始时将向______(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的范围是______。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是______,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是
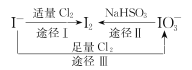
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
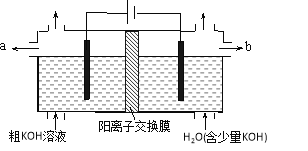
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)A的名称为_____________;
(2)①的反应方程式___________________;①的反应类型___________;
(3)②的反应方程式_____________;②的反应类型是__________________;
(4)浓H2SO4的作用_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
A.1.6molB.2.8molC.3.2molD.3.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应CCl4 +4Na![]() C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于原子晶体
B.该反应利用了Na的强还原性
C.CCl4和C(金刚石)中的C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某兴奋剂的结构简式如下图所示。下列有关说法正确的是 ( )

A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液,紫色褪去,即证明其结构中肯定存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为2 mol和7 mol
D. 该分子中的所有碳原子可以共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com