
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
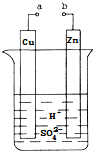
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
【答案】(1)正; 2H++2e-=H2↑;氧化; Cu;
(2)6.5;
(3)否;此反应为非氧化还原反应,且反应吸热.
【解析】
试题分析:(1)a和b用导线连接,锌的活动性位于铜的前面,所以锌发生氧化反应,作原电池的负极,铜作原电池的正极,电极反应式为2H++2e- = H2↑,原电池中阳离子向正极移动,即向铜极移动,答案为:正; 2H++2e-=H2↑;氧化; Cu;
(2)锌被腐蚀的实质是Zn-2e-=Zn2+,所以转移0.2mol电子,被氧化的锌的物质的量为0.1mol,Zn片减少的质量为6.5g,答案为:6.5g;
(3)原电池必须要能够发生自发的氧化还原反应才可以,并且原电池是将化学能转化为电能的装置,要求是放热反应,所以把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池不可行,因为此反应为非氧化还原反应,且为吸热反应,答案为:否;此反应为非氧化还原反应,且反应吸热.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比 。
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO) + c(CH3COOH)= mol/L
c(H+) c(CH3COO) - c(CH3COOH) +2c(OH) (填“>”、“<”或“=”)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是 。
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) ![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L·min)。计算:
(1)5 min末A的物质的量浓度为 。
(2)前5 min内用B表示的化学反应速率v(B)为 。
(3)化学方程式中n值为 。
(4) 5min后A的转化率为 。
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5 mol/(L·min) ②v(B)= 6 mol/(L·min)
③v(C)=4.5 mol/(L·min) ④v(D)=8 mol/(L·min)
其中反应速率最快的是 (填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等。工业制取硝酸铵的工艺流程如下:
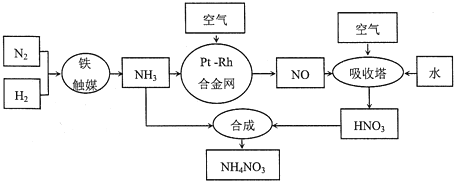
(1)合成氨气的工业设备名称_______________,设备中设置热交换器的目的是____________,合成氨的原料气必须先脱硫,目的是_______________;
(2)吸收塔中反应的化学方程式为_________________________,从生产流程看,吸收塔中需要补充空气,其原因是_______________;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是_______________;
方法三和方法二相比,方法三的缺点是_______________;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.
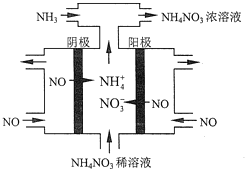
①图中通入NH3的目的是_______________;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_____g;(已知F=96500Cmol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用.
Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。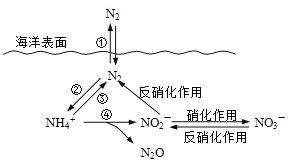
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2 == 2NO2- + ________H+ +__________+__________。
Ⅱ.工业合成氨原理是:N2(g)+3H2(g)![]() 2NH3(g) △H <0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H <0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
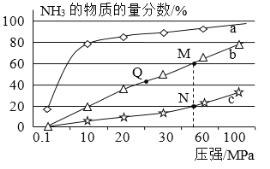
(3)曲线a对应的温度是 。
(4)关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.上图中M、N、Q点平衡常数K的大小关系
是K(M)=K(Q)>K(N)
C.M点比N点的反应速率快
D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100%
(5)如果N点时c(NH3)=0.2mol·L-1,N点的化学平衡常数K= L2/mol2 (精确到小数点后两位)。
Ⅲ.尿素是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)![]() H2NCOONH4(s) ΔH=-272kJ·mol-1
H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(6)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________。
(7)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L的密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
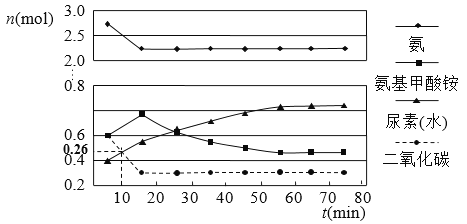
①反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=
mol/(L·min)。
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
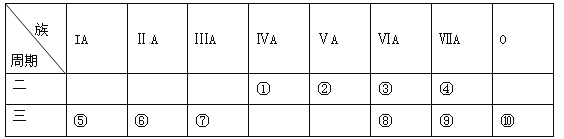
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是一种重要的化工原料,可以参与合成很多物质。下图为以甲苯为原料得到药物苯佐卡因的合成路线。
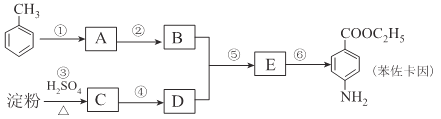
已知:i.苯环上连有甲基时,再引入其他基团主要进入甲基的邻位或对位;苯环上连有羧基时,再引入其他基团主要进入羧基的间位;
Ⅱ.![]() (有弱碱性,易被氧化)。
(有弱碱性,易被氧化)。
请回答下列问题:
(1)化合物C中官能团的结构简式为____________,检验反应③进行程度的试剂有____________。
(2)合成路线中反应类型属于取代反应的有____________个
(3)反应①的化学方程式为____________,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为____________。
(4)反应⑤的化学方程式为____________。
(5)甲苯的链状且仅含碳碳三键的同分异构体有____________种,其中满足下列条件的同分异构体的结构简式为____________。
①核磁共振氢谱只有两个吸收峰②峰面积之比为1:3
(6)化合物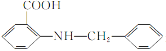 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
提示:①合成过程中无机试剂任选:②合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
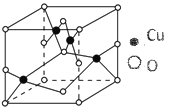
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
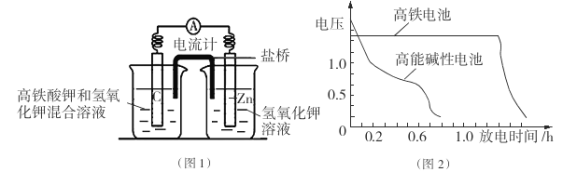
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作10 min ,理论消耗Zn g(已知F=96500 C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有 。
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
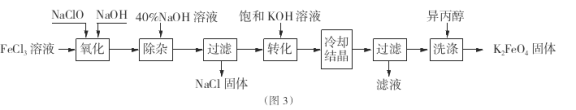
(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L
,此温度下若在实验室中配制5mol/L
l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com