
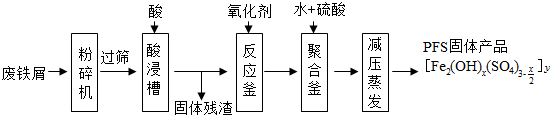
分析 废铁屑粉粹过筛后加入酸浸,过滤得到滤液在反应釜中加入氧化剂氧化亚铁离子为铁离子,加入水和硫酸生成聚合硫酸铁,减压蒸发得到PES固体产品,
(1)铁锈的主要成分是氧化铁水合物,粉碎过筛是选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率;
(2)依据制备的物质聚合硫酸铁可知,酸化反应不能引入新的杂质,需要硫酸酸化,铁锈中氧化铁和酸反应生成铁离子和水;
(3)反应釜中加入氧化剂的作用是氧化亚铁离子为铁离子,氧化剂不引入新的杂质;
(4)铁离子易水解生成红褐色氢氧化铁胶体;
(5)减压蒸发在较低温度下可进行,防止温度过高而导致物质分解;
(6)B=$\frac{3n(OH)}{n(Fe)}$ (n为物质的量),n(OH-)=(V0-V)×10-3×c mol•L-1,n(Fe)=$\frac{mwg}{56g/mol}$=$\frac{mw}{56}$mol.
解答 解:(1)铁锈的主要成分是氧化铁水合物,化学式为:Fe2O3•xH2O,粉碎过筛是选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率,
故答案为:Fe2O3•xH2O;选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率;
(2)依据制备的物质聚合硫酸铁可知,酸化反应不能引入新的杂质,需要硫酸酸化,铁锈中氧化铁和酸反应生成铁离子和水,反应的离子方程式为:Fe2O3•xH2O+6H+=2Fe3++(x+3)H2O,
故答案为:H2SO4;Fe2O3•xH2O+6H+=2Fe3++(x+3)H2O;
(3)反应釜中加入氧化剂的作用是氧化亚铁离子为铁离子,氧化剂不引入新的杂质,A、B、D都会引入新的杂质,C中过氧化氢被还原生成水无杂质离子引入,故答案为:C;
(4)铁离子易水解生成红褐色氢氧化铁胶体,聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则容易生成Fe(OH)3,产率降低,
故答案为:容易生成Fe(OH)3,产率降低;
(5)减压蒸发在较低温度下可进行,防止常压蒸发温度过高聚合硫酸铁分解,
故答案为:可以防止温度过高,聚合硫酸铁分解;
(6)n(OH-)=(V0-V)×10-3×c mol•L-1,n(Fe)=$\frac{mwg}{56g/mol}$=$\frac{mw}{56}$mol,B=$\frac{3n(OH)}{n(Fe)}$ (n为物质的量)=3×$\frac{({V}_{0}-V)×1{0}^{-3}L×cmol/L}{\frac{mw}{56}mol}$=$\frac{0.168c({V}_{0}-V)}{mw}$,
故答案为:$\frac{0.168c({V}_{0}-V)}{mw}$.
点评 本题考查了物质组成探究、物质性质的分析、试剂选择和离子反应实质的理解应用,注意信息的分析,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH4与P4的分子结构都是正四面体形,因此在6.02×1023个CH4分子或P4分子中都含有4×6.02×1023个共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si-O键 | |
| C. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
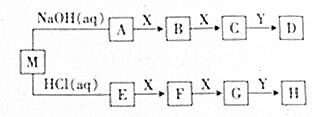 几种中学常见的短周期元素组成几种物质,它们的转化关系如图所示(部分条件和产物省略).已知M是酸式盐,只有X是单质,B、C、F、G、Y都是氧化物,D和H是两种常用的强酸.
几种中学常见的短周期元素组成几种物质,它们的转化关系如图所示(部分条件和产物省略).已知M是酸式盐,只有X是单质,B、C、F、G、Y都是氧化物,D和H是两种常用的强酸. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
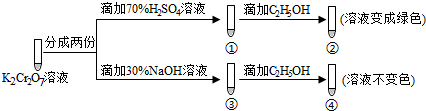
| A. | ①中溶液橙色加深,③中溶液变黄 | |
| B. | ②中Cr2O72-被C2H5OH还原 | |
| C. | 对比②和④可知K2Cr2O7酸性溶液氧化性强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气作水的杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 肥皂水作蚊虫叮咬处的清洗剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl | |
| B. | 阴极自始至终只产生H2 | |
| C. | 电解过程中,溶液的pH不断增大,最后等于7 | |
| D. | 电解过程中,Na+和SO42-的物质的量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
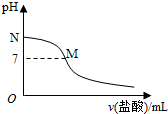
| A. | 该滴定过程应该选择酚酞作为指示剂 | |
| B. | M点对应的盐酸体积为20.0mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
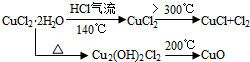
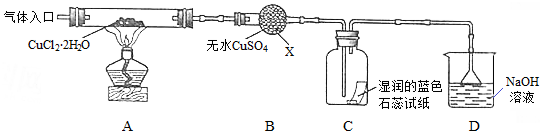
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
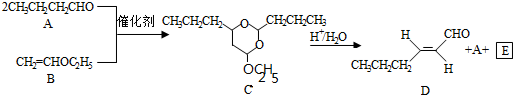
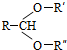 $\stackrel{H+/H_{2}O}{→}$RCHO+R′OH+R″OH
$\stackrel{H+/H_{2}O}{→}$RCHO+R′OH+R″OH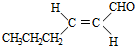 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$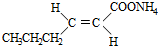 +2Ag↓+3NH3+H2O(或者
+2Ag↓+3NH3+H2O(或者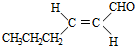 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$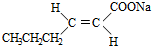 +Cu2O↓+3H2O).
+Cu2O↓+3H2O).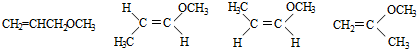

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com