
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol·L-1 pH=7.82的NH4HCO3溶液中:c(HCO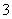 )>c(NH
)>c(NH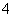 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合:
[c(NH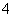 )+c(H+)]>[c(NH3·H2O)+c(OH-)]
)+c(H+)]>[c(NH3·H2O)+c(OH-)]
C.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合:
2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
【知识点】溶液中的离子浓度关系H1 H2 H6
【答案解析】BD 解析:A、0.1 mol·L-1 pH=7.82的NH4HCO3溶液略显碱性,说明水解程度HCO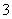 >NH
>NH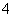 :所以溶液中微粒的物质的量浓度关系c(NH
:所以溶液中微粒的物质的量浓度关系c(NH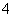 )>c(HCO
)>c(HCO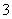 )>c(OH-)>c(H+),故A错误;B、浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合,根据电荷守恒:c(NH
)>c(OH-)>c(H+),故A错误;B、浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合,根据电荷守恒:c(NH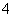 )+c(H+)=c(Cl-)+c(OH-),由于c(NH3·H2O)>c(Cl-),所以[c(NH
)+c(H+)=c(Cl-)+c(OH-),由于c(NH3·H2O)>c(Cl-),所以[c(NH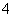 )+c(H+)]>[c(NH3·H2O)+c(OH-)],故B正确;C、根据质子守恒,0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;D、0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合时钠与硫原子的物质的量比为3:2,即2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) ,故D正确。
)+c(H+)]>[c(NH3·H2O)+c(OH-)],故B正确;C、根据质子守恒,0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;D、0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合时钠与硫原子的物质的量比为3:2,即2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) ,故D正确。
故答案选BD
【思路点拨】本题考查溶液中的离子浓度关系,理解物料守恒、电荷守恒、质子守恒式关键。


科目:高中化学 来源: 题型:
下列各组微粒,氧化性由强到弱排列顺序正确的是( )
A.F-、Cl-、Br-、I- B. Na+、Zn2+、H+、Cu2+
C. F2、Cl2、Br2、I2 D. Cu、Fe、Al 、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃时,将5 mol A和7 mol B气体通入体积为10 L的密闭容器中(容积不变),反应过程中A、B、C浓度变化如下图1所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如下图2所示:
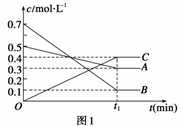
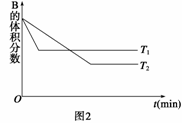
则下列结论正确的是( )
A.T℃时,将4 mol A,4 mol B和2 mol C气体通入体积为10 L的密闭容器中(容积不变),达到平衡时,C的浓度为0.4 mol·L-1
B.保持其他条件不变,在(t1+10) min时,加入催化剂,平衡向正反应方向移动
C.保持其他条件不变,在(t1+10) min时,通入稀有气体,平衡向逆反应方向移动
D.保持其他条件不变,升高温度,正、逆反应速率均增大,A的转化率也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
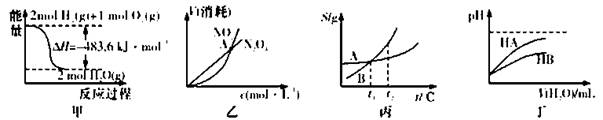
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
分类在科学研究中必须用的方法,下列关于化学的分类说法正确的是 ( )
A.干冰、HD均为化合物;水玻璃、水银均为混合物;纯碱和生石灰分别属于碱和氧化物;蔗糖、PVC、淀粉都是高分子化合物
B.根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等
C.由于饱和碳酸钙的导电性比饱和氨水的导电性弱,所以碳酸钙是弱电解质
D.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.向氨水中滴加饱和氯化铁溶液并加热制备Fe(OH)3胶体
B.水晶、玻璃、陶瓷等都是硅酸盐制品
C.在袋装食品中,常用生石灰作抗氧剂
D.化学家用CO2和环氧丙烷制造的塑料代替聚乙烯塑料可减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
2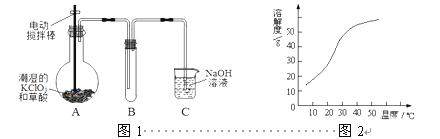
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;(2)NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,
则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75 ,该溶液中c(A2-)< c(H2A)
C.室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol·L-1时,
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol·L-1时,
溶液的pH等于14+ 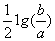
D.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com