
| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
分析 一水合氨为弱碱,氨水的浓度大于0.001mol/L,pH=3的盐酸浓度为0.001mol/L,pH=3的某酸中氢离子浓度为0.001mol/L,酸的浓度≥0.001mol/L;X为氯化铵和氨水的混合液,溶液一定呈碱性,Y溶液酸碱性无法确定,据此进行解答.
解答 解:常温下pH=11的氨水中氢氧根离子浓度为0.001mol/L,氨水浓度大于0.001mol/L,
该氨水与pH=3的盐酸混合,所得溶液X为氨水和氯化铵的混合液,溶液呈碱性,故A、B错误;
pH=3某酸中氢离子浓度为0.001mol/L,若酸为强酸,则氨水过量,Y溶液呈碱性;若该酸为弱酸,Y溶液可能为中性或酸性,故D错误、C正确,
故选C.
点评 本题考查弱电解质的电离平衡及其应用,题目难度不大,明确弱电解质部分电离的特点为解答关键,注意掌握讨论法的应用,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,溶液中OH- 移向正极 | |
| D. | 原电池工作时,溶液中电子由负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
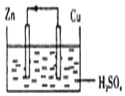
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2与NaOH均既含离子键又含共价键,均属离子化合物 | |
| B. | BaCO3与H2SO4化学键类型不完全相同,均属强电解质 | |
| C. | 乙醇与醋酸,均只含共价键,均属非电解质 | |
| D. | 氯气与氧气,均只含共价键,均只做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.| 化学键 | H-H(g) | H-O(g) | O≡O(g) |
| 键能(KJ/mol) | 436 | 463 | 496 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com