
【题目】(6分)“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g/mol-1 ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%氧元素的质量分数为28%,其余为N、S。(写计算过程)
(1)误食0.1 g“毒鼠强”就可以使人死亡,0.1g“毒鼠强”的物质的量为多少?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比。
科目:高中化学 来源: 题型:
【题目】用30g乙酸和46g 乙醇反应,如果实际产量是理论产量的85%,则可得到的乙酸乙酯的质量是( )
A.37.4g
B.44g
C.74.8g
D.88g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定一小块铁铝合金样品中的含铝量,现先将其溶于足量盐酸中,然后再向其中加入足量的烧碱溶液,待沉淀全部转化为红褐色时过滤,洗涤。将沉淀物在空气中灼烧,最后得到红棕色粉末,经称量知其质量跟原合金的质量相等。合金中铝的质量分数为( )
A.70%
B.30%
C.54%
D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol氢为2 g B. H2O的摩尔质量为18 g
C. 44 g CO2的体积为22.4 L D. 9.8 g H2SO4含0.1NA个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为个.
(2)①H2O分子内的O﹣H键、②分子间的范德华力和③氢键从强到弱依次为(填序号即可) .
(3)对羟基苯甲醛的沸点比邻羟基苯甲醛高,理由是 .
(4)H+可与H2O形成H3O+ , H3O+中O原子采用杂化轨道.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1.5 mol O2体积是33.6 L
B. 在标准状况下,2 mol H2的体积是44.8 L
C. 不同的气体,若体积不同,则它们所含的分子数也不同
D. 气体摩尔体积指1 mol任何气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A﹣D间存在图示的转化关系. 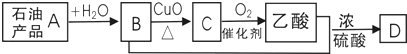
下列说法不正确的是( )
A.D结构简式为CH3COOCH2CH3
B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应
D.可用B萃取碘水中的碘单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com