
| A. | Fe2+、CH3COO-、Na+、SO42 | B. | K+、Ca2+、HCO3-、Cl- | ||
| C. | Al3+、NH4+、Cl-、NO2 | D. | K+、Na+、SiO32、AlO2- |
分析 二氧化氮与水反应生成硝酸和NO,硝酸具有强氧化性,
A.稀硝酸能够氧化亚铁离子,醋酸根离子与氢离子反应;
B.碳酸氢根离子与氢离子反应;
C.四种粒子之间不反应,都不与稀硝酸反应,能够共存;
D.硅酸根离子、偏铝酸根离子与氢离子反应.
解答 解:NO2通入溶液中发生反应:3NO2+H2O═2HNO3+NO,
A.Fe2+被硝酸氧化成Fe3+,CH3COO-与氢离子反应生成醋酸,在溶液中不能大量共存,故A错误;
B.HCO3-与稀硝酸反应生成二氧化碳气体,在溶液中不能大量共存,故B错误;
C.Al3+、NH4+、Cl-、NO2之间不发生反应,都不与稀硝酸反应,在溶液中能够大量共存,故C正确;
D.SiO32、AlO2-与H+反应分别生成H2SiO4和Al3+,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:二氧化氮溶于水生成稀硝酸,稀硝酸具有强氧化性和酸性.


科目:高中化学 来源: 题型:选择题
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:$ClO_3^-$+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,AB将完全分解 | |
| B. | 达到化学平衡时,AB、A2、B2的物质的量浓度比一定为2:1:1 | |
| C. | 达到化学平衡时,AB、A2、B2 的浓度一定不再变化 | |
| D. | 达到化学平衡时,正、逆反应速率相等且为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入合金的质量不可能为6.6g | |
| B. | 参加反应的硝酸的物质的量浓度为1mol/L | |
| C. | 生成沉淀完全时消耗NaOH溶液的体积为100 mL | |
| D. | 生成NO气体体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向燃烧正旺的炉火上洒一些水 | B. | 把煤炭做成大煤球 | ||
| C. | 把煤中掺一些黄泥做成蜂窝煤 | D. | 把煤粉碎,在煤粉燃烧器中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 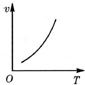 | B. | 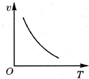 | C. | 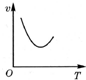 | D. | 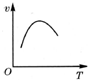 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子由锌经外电路流向氧化银 | |
| B. | 该电池可实现化学能和电能的相互转化 | |
| C. | 锌是负极,氧化银是正极 | |
| D. | 工作时,负极区溶液pH减小,正极区pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com