
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
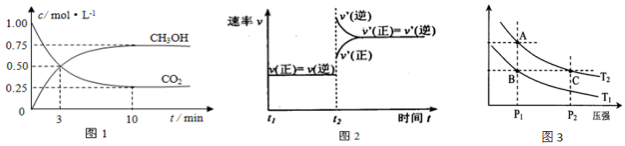
���� ��1���ٷ���ͼ���¶�����k��С�������淴Ӧ�����ƶ���2H2��g��+CO��g��?CH3OH��g����Ӧ��������ʵ������٣����ݻ�ѧ����ʽ��ƽ�ⳣ��������д������ƽ�ⳣ�����¶ȱ仯�жϷ�Ӧ�����仯��
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c��CO��=0.2mol/L����
CO��g��+2H2��g���TCH3OH��g��
��ʼŨ�ȣ�mol����1 3 0
�仯Ũ�ȣ�mol����0.8 1.6 0.8
ƽ��Ũ�ȣ�mol����0.2 1.4 0.8
����K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$����ƽ�ⳣ���������ж��¶�
��CH3OH��ʾ�ù��̵ķ�Ӧ���ʣ�v��CH3OH��=$\frac{��c��C{H}_{3}OH��}{��t}$
��2��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죻A��C���㶼�ڵ������ϣ�ƽ�ⳣ��ֻ���¶��йأ��÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���
��1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽ��֪������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��3��Ϊ2.25mol/L���ݴ˼��㣻�ȸ���Ũ�ȱ仯����ƽ��ʱ�����ʵ�Ũ�ȣ�CH3OH������������ڼ״������ʵ���Ũ���������ʵ���Ũ��֮�ȣ�
��2�����������¶�ƽ�������ȷ�Ӧ�����ƶ��жϣ�
��3��Ҫ���CO2��ת���ʣ�Ӧʹƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ�����ѡ���жϣ�
��� �⣺��1���ٷ���ͼ���¶����ߺ�K��С��˵����Ӧ�淽���ƶ������÷�ӦΪ���ȷ�Ӧ����H��0��2H2��g��+CO��g��?CH3OH��g����Ӧ��������ʵ������٣����ԡ�S��0���ʴ�Ϊ����������
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c��CO��=0.2mol/L����
CO��g��+2H2��g���TCH3OH��g��
��ʼŨ�ȣ�mol����1 3 0
�仯Ũ�ȣ�mol����0.8 1.6 0.8
ƽ��Ũ�ȣ�mol����0.2 1.4 0.8
����K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$=$\frac{0.8}{0.2��1��{4}^{2}}$=2.042�����¶�Ϊ250�棬
v��CH3OH��=$\frac{��c��C{H}_{3}OH��}{��t}$=$\frac{0.8mol/L}{10min}$=0.08mol/��L•min����
�ʴ�Ϊ��250�棻0.08��
��3��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죬��������ΪC��A��
A��C���㶼�ڵ������ϣ�ƽ�ⳣ��ֻ���¶��йأ����Ի�ѧƽ�ⳣ��ΪA=C��
�÷�ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ���NO2�������������������״̬B��״̬A�������ü��ȵķ�����
�ʴ�Ϊ������=�� ���£�
��1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽCO2��g��+3H2��g��?CH3OH��g��+H2O��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��Ϊ0.75mol/L��3=2.25mol/L����v��H2��=$\frac{2.25mol/L}{10min}$=0.225mol/��L•mon����
��ʼʱc��CO2��=1mol/L��c��H2��=3mol/L��ƽ��ʱc��CO2��=0.25mol/L��c��CH3OH��=c��H2O��=0.75mol/L����c��H2��=3mol/L-0.75mol/L��3=0.75mol/L��CH3OH������������ڼ״������ʵ���Ũ���������ʵ���Ũ��֮�ȣ����Լ״����������=$\frac{0.75mol/L}{��0.25+0.75+0.75+0.75��mol/L}$��100%=30%��
�ʴ�Ϊ��0.225mol/��L•min����30%��
��2������ͼ��֪�������¶ȣ��淴Ӧ���ʴ�������Ӧ���ʣ�ƽ�����淴Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3��A����ԭ�������ٳ���1mol H2��ƽ��������Ӧ�����ƶ���CO2��ת����������ȷ��
B����ԭ�������ٳ���1molCO2CO2��ת���ʷ�����С���ʴ���
C����С�������ݻ�������ѹǿ��ƽ��������Ӧ�����ƶ���CO2��ת����������ȷ��
D��ʹ�ø���Ч�Ĵ�����ƽ�ⲻ�ƶ���CO2��ת���ʲ��䣬�ʴ���
�ʴ�Ϊ��BD��
���� ������Ҫ����ƽ��״̬���жϡ�Ӱ��ƽ���ƶ������ء�ת���ʡ���Ӧ���ʵļ��㡢�缫��Ӧ����д����һ�����ۺ��ԣ��е��Ѷȣ�


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������У��������
A. ��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
B. ����ʱ��Ӧʹ�¶ȼ�ˮ����λ��������ƿ֧�ܿڴ�
C. �þƾ���ȡ��ˮ��Һ�еĵ�
D. ����ʱ©���¶˼���Ӧ���ձ��ڱڽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵ�һ��ѧ�ο��Ի�ѧ���������棩 ���ͣ�ѡ����
�ڡ���ɫ��ѧ�������У������״̬�Ƿ�Ӧ���е�ԭ��ȫ��ת��Ϊ���������ղ����ԭ�ӵ�������Ϊ100%�����з�Ӧ�����������֡�ԭ�Ӿ����ԡ�ԭ����ǣ� ��
���û���Ӧ �ڻ��Ϸ�Ӧ �۷ֽⷴӦ ��ȡ����Ӧ �ݼӳɷ�Ӧ �Ӿ۷�Ӧ
A���٢ڢ� B���ڢݢ� C���ۢ� D��ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | �ܽ��� |
| A | -11.5 | 198 | 1.11 | A��B���ܣ��Ҿ�������ˮ |
| B | 17.9 | 290 | 1.26 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a=b=c | B�� | b��a��c | C�� | b��c��a | D�� | b=c��a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
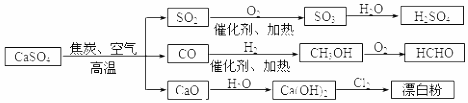
| A�� | CO��SO2��Ϊ��ɫ�д̼�����ζ���ж����� | |
| B�� | ��ҵ������Cl2 �ͳ���ʯ��ˮ��Ӧ����ȡƯ�� | |
| C�� | ��ȥ��ˮ��Ӧ��ͼʾת����Ӧ��Ϊ������ԭ��Ӧ | |
| D�� | ��CO�ϳ�CH3OH�����ϳ�HCHO��������Ӧ��ԭ�������ʾ�Ϊ100% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
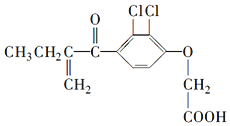
| A�� | ����������������������ķ���ʽ��C14H14Cl2O4 | |
| B�� | ����������ڴ���ͬһƽ���ԭ�Ӳ�����10�� | |
| C�� | 1mol����������7mol H2�����ӳɷ�Ӧ | |
| D�� | ����������FeCl3��Һ������ɫ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com