
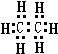 ,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20. 分析 乙烷分子式为:C2H6,分子中碳原子与氢原子之间形成1对共用电子对,碳原子与碳原子之间形成1对共用电子对;
烷烃为饱和烃通式为:CnH(2n+2),据此计算分子式为CmH20的烷烃中m;
同温同压下,密度之比等于摩尔质量之比,据此写出CO2密度(同温同压)相同的烷烃分子式;
设烃分子式为CxHy,则1mol烃消耗氧气的物质的量为:x+$\frac{y}{4}$,该值越大耗氧量越多.
解答 解:因碳原子的最外层有4个电子,氢原子最外层1个电子,一个碳原子形成4对共用电子对,一个氢原子形成一对共用电子对,所以电子式为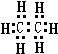 ;
;
据烷烃的通式CnH(2n+2),分子式为CmH20的烷烃中H为20,则2m+2=20,所以m=9;
同温同压下,密度之比等于摩尔质量之比,与CO2 密度(同温同压)相同的烷烃分,其相对分子质量应该和二氧化碳的相等,即为44,分子式为C3H8;
若上述四种烃各为1mol,1mol烃的耗氧量=x+$\frac{y}{4}$,分别是1molC2H6、C9H20、C3H8在足量O2中燃烧,消耗O2分别是:3.5mol、14mol、5mol,所以耗O2最多的是C9H20;
故答案为: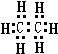 ;9;C3H8;C9H20.
;9;C3H8;C9H20.
点评 本题考查了烷烃电子式的书写、通式的应用、烃燃烧的耗氧规律,难度不大,注意对规律的理解与掌握.


科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
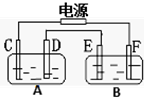
| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
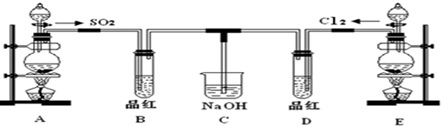
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com