
����Ŀ��ͭ����Ļ������ڻ�����ҽҩ���ϵ�������й㷺����;���ش���������:
��1��ԭ�ӹ����ָ������ԭ�Ӻ����___________����̬Sԭ�ӵ�ԭ�ӹ������____����
��2����̬Cuԭ����,�������ռ�ݵ�ԭ�ӹ��Ϊ���ε�����ܼ�������______��ռ�ݸ��ܼ��ĵ�����Ϊ__________��
��3��Cl��S��Se��Ԫ�����ڱ��д������ڵ�λ��,���һ�����ܵĴ�С˳��Ϊ_______��
��4����ͼ�Ǻ�Ԫ��Cu��S���л���Ľṹ��ʽ:

�ٸ��л�������ṹ�к��еĻ�ѧ��������_______(�������ۼ��������Ӽ����������ۼ������Ӽ���)����λ��,����1�����л����������λ����Ϊ_____��,��Щ��λ�����ṩ�µ��ӶԵ�Ԫ����__________��
��Sԭ�ӵ��ӻ���ʽΪ_______����*Nԭ�ӵ��ӻ���ʽΪ_______��
��5����ͼ��Cu-Au�Ͻ��һ����������ṹ:
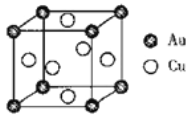
��֪�úϽ���ܶȷ�dg/cm3,�����ӵ�������ֵΪNA����Auԭ�ӵİ뾶Ϊbpm(lpm=10-10cm)����ͭԭ�ӵİ뾶Ϊ______cm(д���������ʽ)��
���𰸡� �ռ��˶�����Ҫ���� 9 4s 1 Cl>S>Se ���ۼ� 2 N��O sp3 sp2 
����������1��ԭ�ӹ����ָ������ԭ�Ӻ���Ŀռ��˶�����Ҫ����̬Sԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p4��s���ֻ��1�������p�����3�������������ԭ�ӹ������9����
��2����̬Cuԭ�������������ռ�ݵ�ԭ�ӹ��Ϊ���ε�����ܼ�������4s��ռ�ݸ��ܼ��ĵ�����Ϊ1��
��3��Cl��S��Se��Ԫ�����ڱ��д������ڵ�λ����Cl��Sͬ������S��Seͬ���壬��ǽ�������ǿ������˳��ΪCl>S>Se�����һ�����ܵĴ�С˳��ΪCl>S>Se��
��4���ٸ��л�������ṹ�к��еĻ�ѧ�������ǹ��ۼ�����λ�������л��������Cuԭ����3��Nԭ�Ӻ�1��Oԭ�ӳɼ�������N��O��ԭ�ӽṹ����ɼ�����������ж� 1�����л����������λ������ĿΪ2������Щ��λ�����ṩ�µ��ӶԵ�Ԫ����N��O��
�ڸ��л��������Sԭ��ֻ�γ���2���Ҽ�����Sԭ�ӵ��ӻ���ʽΪsp3����*Nԭ�ӹ��γ�3��������1�������������ӻ���ʽΪsp2��
��5����Cu-Au�Ͻ�ľ���ṹ��֪���侧����Cu��Auԭ�ӷֱ�λ�ھ��������ĺͶ��㣬���Ծ�����Cu��Auԭ�����ֱ�Ϊ3��1����֪�úϽ���ܶȷ�dg/cm3,�����ӵ�������ֵΪNA����Auԭ�ӵİ뾶Ϊbpm(lpm=10-10cm)����Cuԭ�ӵİ뾶Ϊx�������ı߳�Ϊa����![]() ��a=
��a=![]() pm��NA������������������ֱ�Ϊ389g��
pm��NA������������������ֱ�Ϊ389g��![]() ������
������![]() ����ͭԭ�ӵİ뾶Ϊ
����ͭԭ�ӵİ뾶Ϊ![]() cm��
cm��


 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2��g��+B2��g���T2AB��g���������仯��ͼ��ʾ���ж�������������ȷ���ǣ�������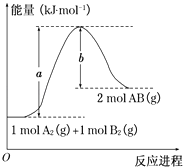
A.ÿ����2����AB����b kJ����
B.�÷�Ӧ�ȡ�H=+��a��b��kJmol��1
C.�÷�Ӧ�з�Ӧ��������������������������
D.����1 mol A��A��1 mol B��B�����ų�a kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ַ�����һ������Դ��������ȼ������������Ҫ�ɷ��Ǽ�����ӵĽᾧˮ����(CH4��nH2O)�����γɹ����ǣ����ں��ز���Ĵ����л�����ȱ�������У�������ϸ�����л��ʷֽ⣬����γ�ʯ�ͺ���Ȼ��������������Ȼ��������ˮ�����У��ں��ĵ������ѹ���γ������Ʊ��������壬���������ȼ��������������ȼ�����ľ���������( )
A. ���Ӿ��� B. ���Ӿ��� C. ԭ�Ӿ��� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۻ�ʱ�����ƻ��Ǽ��Թ��ۼ����� �� ��
������ �£������
�ã��嵥�� �ģ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��֤Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ʵ�顣
I.(1)���ơ��ء�þ������1mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ������_____�����ᷴӦ����ң�____�����ᷴӦ������������_____�����ᷴӦ������������ࡣ
(2)��Na2S��Һ��ͨ���������ֵ���ɫ���ǣ���֤��C1�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ��_______________��
II.������ͼװ�ÿ���֤ͬ����ǽ����Եı仯���ɡ�
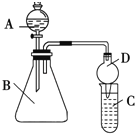
(3)����B������Ϊ__________�������D������Ϊ___________��
(4)��Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽�����Һ_____��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�����_____��Һ����β����
(5)��Ҫ֤���ǽ����ԣ�C��Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ�۲쵽C����Һ______��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ�Ӧ��______��Һ��ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ��ҵ�����Ĵ������Ʊ�����MgO�IJ���������þ(MgC2O4��2H2O)���Ź�����Ӧ�úͷ�չǰ�����ش�����������
��1��MgC2O4��2H2O���Ʊ�

��֪�Ȼ�þ������李�����þ��ˮ�е��ܽ�����±�:
�Ȼ�þ | ����� | ����þ | |
20�� | 54.6g | 4.45g | �� |
70�� | 61.0g | 22.4g | |
100�� | 73.3g | 34.7g |
ʵ�鷽��:��i�������������ˮ��ȡ300mL��ȴ��70��,��140g MgCl2��6H2O������MgCl2��Һ��
��ii������ͼʾװ��װ��ҩƷ�����Ӻ�װ����
��iii���ڴ������Ƚ��������£��������뱥��(NH4)2C2O4��Һ����ˮԡ���ȣ�ֱ�����ٲ�����ɫ����Ϊֹ��
��iv�����������ϴ�ӣ���MgC2O4��2H2O������
��װ����������������_____,����ˮ��ˮ��Ϊ_____����a������b��)��
����������c���������____________________��
�������Ʒϴ�Ӹɾ��ķ�����________________��
��2��MgC2O4��2H2O�ֽ�����̽��
������ͼ��ʾװ��̽��MgC2O4��2H2O�ֽ����CO��CO2 �ȵ����ʡ�
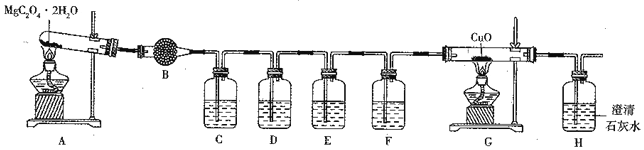
��A�з�����Ӧ�Ļ�ѧ����ʽΪ______________________��
��װ��B��ʢװ��ҩƷ��_____��װ��C��������______��װ��D�е��Լ���______��װ��G�е�������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ���������ֵ������˵����ȷ����
A. �ڱ�״����.11.2L���麬�еļ��Լ���ĿΪ5NA
B. 7g��ڿ�������ȫȼ��ʱת�Ƶĵ�����ΪNA
C. 1mol������(C6H12O6)���Ӻ��е��ǻ���ĿΪ6NA
D. �����£�0.2L0.5mol/LNH4NO3��Һ�к��еĵ�ԭ����С��0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܻ�óɹ������� ��
A. ������KMnO4��Һ������ϩ���ҿ� B. ����������ˮ��Ϲ�����������
C. �����������Ļ������÷�Һ�ķ������� D. ����CCl4��ȡ��ˮ�еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮
ʵ��I����Ӧ����Ķ���̽��
����ͼװ�ã��̶�װ������ȥ������ʵ��

��1��Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��____________��Bװ�õ�������________Eװ���е�������_______��
��2��ʵ������У���֤�����������ɵ�������________��
��3��Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ��_____________________��
ʵ���Ӧ����Ķ���̽��
��4��Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00 mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00 mL 0.30 molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ6.4g��������ͭ�IJ���Ϊ________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I������ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com