
 如图表是元素周期表的一部分,其中a、b、c、d是序号,其它为元素符号.
如图表是元素周期表的一部分,其中a、b、c、d是序号,其它为元素符号.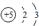 ;
;分析 表是元素周期表的一部分,其中a、b、c、d是序号,结合位置可知,a为9,b为11,c为13,d为14,对应元素分别为F、Na、Al、Si,B为B,
(1)B的原子序数为5;
(2)Si与F只能以共用电子对成键;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小;
(4)NaOH和氢氧化铝反应生成偏铝酸钠和水;
(5)A.位于阶梯虚线附近的元素,在金属与非金属的交界处;
B.在过渡元素区寻找催化剂;
C.F无正价;
D.表中Cs的金属性最强.
解答 解:表是元素周期表的一部分,其中a、b、c、d是序号,结合位置可知,a为9,b为11,c为13,d为14,对应元素分别为F、Na、Al、Si,B为B,
(1)B的原子序数为5,原子结构示意图为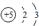 ,故答案为:
,故答案为: ;
;
(2)Si与F只能以共用电子对成键,二者以共价键结合,故答案为:共价键;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小,则a、b、c三种元素中,原子半径最大的是钠,离子半径最大的是F-,
故答案为:钠;F-;
(4)NaOH和氢氧化铝反应生成偏铝酸钠和水,离子反应为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(5)A.位于阶梯虚线附近的元素,在金属与非金属的交界处,则元素既表现某些金属的性质,又表现某些非金属的性质,故A正确;
B.在过渡元素区寻找催化剂,不能在阶梯虚线附近寻找催化剂,故B错误;
C.F无正价,不存在最高价含氧酸,高氯酸的酸性最强,故C错误;
D.由同主族从上到下金属性增强,同周期从左向右金属性减弱可知表中Cs的金属性最强,故D正确;
故答案为:BC.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水具有挥发性 | B. | 1mol/L硝酸铵溶液pH约为5 (室温) | ||
| C. | 氨水能与硫酸发生化学反应 | D. | 氨水导电能力较弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该酒在55℃的条件下酿造 | B. | 该酒的沸点为55℃ | ||
| C. | 100mL该酒中含乙醇55mL | D. | 100g该酒中含乙醇55g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素属于二糖,能发生水解,但不能发生银镜反应 | |
| B. | 蛋白质水解的最终产物为多肽 | |
| C. | 相对分子质量为105000的聚丙烯其聚合度为2500 | |
| D. | 仅用新制的氢氧化铜试剂可以证明淀粉已部分水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com