
| n |
| V |
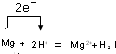 ,
, ;
;| 2.4g |
| 24g/mol |
| 0.1mol |
| 1mol |
| 0.1mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将58.5g NaCl固体溶于1 L水中所得溶液 |
| B、将22.4L HCl气体溶于水配成1 L的溶液 |
| C、从1L 10mol/L的浓盐酸中取出的100mL溶液 |
| D、将4g NaOH固体溶于水中配成的100 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的实质是元素化合价发生了变化 |
| B、氧化剂被还原,还原剂被氧化;氧化剂具有氧化性,还原剂具有还原性 |
| C、得到电子的物质被氧化,失去电子的物质被还原 |
| D、氧化还原反应中,氧化剂和还原剂一定是两种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合物KCrO2中Cr元素为+3价 |
| B、实验①证明Cr2O3是两性氧化物 |
| C、实验②证明氧化性:Cr2O72-<I2 |
| D、实验③证明H2O2有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B、氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
| C、氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
| D、最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
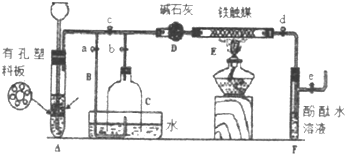
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com