
已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
|
容器 编号 |
起始时各物质物质的量/mol |
达平衡过程体系 |
|||
|
CO |
H2O |
CO2 |
H2 |
能量的变化 |
|
|
① |
1 |
4 |
0 |
0 |
放出热量:32.8 kJ |
|
② |
0 |
0 |
1 |
4 |
热量变化:Q |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器②中吸收的热量O为32.8 kJ
C.平衡时,两容器中CO2的浓度相等
D.容器①中当CO反应速率等于H2O的反应速率时,反应可能达到平衡
C
【解析】
试题分析:根据已知方程式可知,1molCO完全反应放出41kJ热量,而容器①放出32.8 kJ热量,所以转化率为32.8 kJ÷41kJ=0.8,所以A正确;根据反应方程式中气体系数相等的特点,容器②的CO2物料配比与容器①中CO相同,所以在相同条件下反应,两种情况下的转化率相等,因为正反应为放热反应,所以逆反应应为吸热,同样吸收32.8 kJ热量,B正确;由于2容器中含C物质的转化率相同,所以CO2的浓度不相等,C错误;方程式中 CO与H2O的反应系数相等,所以反应速率相等,达到平衡时也相等,所以当CO反应速率等于H2O的反应速率时反应也有可能达到平衡,所以D正确;故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 已知:①CO(g)+
已知:①CO(g)+| 1 |
| 2 |
|
| 1 |
| 2 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省五市十校高三第一次联合检测化学试卷(解析版) 题型:填空题
( 10分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。已知:CO(g) + H2O(g) H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
850 |
|
平衡常数 |
9.94 |
9 |
1 |
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
t1℃时物质浓度(mol/L)的变化

|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量 (填增大、减小或不变)。
②表中3 min~4 min之间反应处于 状态;CO的体积分数 16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期质量检测化学试卷 题型:填空题
一氧化碳是一种用途相当广泛的化工基础原料。
⑴利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)  Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
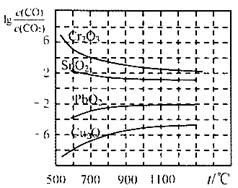
⑵金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下左图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg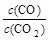 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
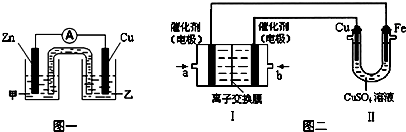
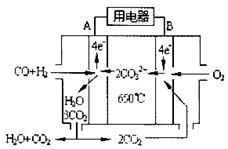
⑶下右图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。依次写出A、B两电极发生反应的电极反应式
__________________________________、___________________________________。
⑷已知:①CO(g)+2H2(g) CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=_______________。
CH3OCH3(g)+CO2(g)的△H=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com