
【题目】配制960 mL 0.3mol/L NaOH溶液。具体如下:
(1)需称取_________g NaOH。
(2)配制过程中除烧杯、托盘天平、玻璃棒,还需要用到主要玻璃仪器是__________。
(3)下列操作会使配制的溶液浓度偏低的是___________(填字母)。
A、配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体
B、配制氢氧化钠溶液时,容量瓶中有少量水
C、发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线
D、定容时俯视容量瓶刻度线
【答案】12.0 1000mL容量瓶、胶头滴管 AC
【解析】
(1)配制960 mL 0.3mol/L NaOH溶液,需选用1000 mL容量瓶,根据m=cVM计算需要氢氧化钠的质量;
(2)根据实验步骤分析仪器;
(3)根据![]() 分析误差。
分析误差。
(1)配制960 mL 0.3mol/L NaOH溶液,需选用1000 mL的容量瓶, m(NaOH)=0.3mol/L×1L×40g/mol=12.0g;
(2)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后用玻璃棒引流,转移到1000mL容量瓶中,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀;所以所需仪器除托盘天平、烧杯、玻璃棒外,还必须用到的仪器有1000mL容量瓶、胶头滴管等;
(3)A、配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体,氢氧化钠物质的量偏小,则配制的溶液浓度偏低,故选A;
B、配制氢氧化钠溶液时,最后要加水定容,实验前容量瓶中有少量水,对配制的溶液浓度无影响,故不选B;
C、发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线,氢氧化钠物质的量偏小,则配制的溶液浓度偏低,故选C;
D、定容时俯视容量瓶刻度线,溶液的体积偏小,则配制的溶液浓度偏高,故不选D;
选AC。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
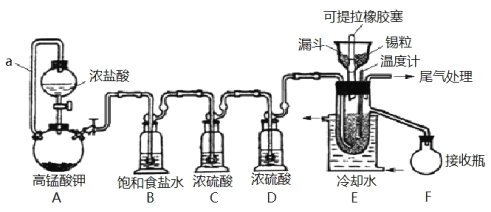
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
(5)尾气处理时,可选用的装置是___(填序号)。
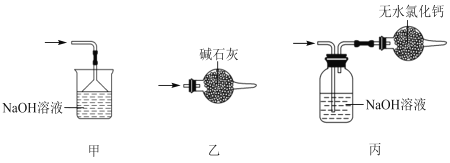
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有H、D、T三种原子,各自可形成双原子分子H2、D2、T2,请填写下列各题。
①标准状况下,它们的密度之比为_____。
②相同物质的量的三种单质中,质子数之比为_____。
③各1g三种单质中,它们的质子数之比为_____。
④同温同压下,1LD2和T2气体中所含中子数之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
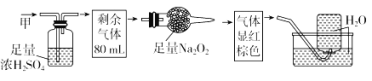
A. NH3、NO2、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5molN2O4气体通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol/L。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是( )
A.前2s,以NO2浓度变化表示的平均反应速率为0.005mol·L-1·s-1
B.在2s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O4的物质的量为0.25mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的是( )
①环丙烷和乙烯的最简式相同②相同质量的乙炔和苯充分燃烧耗氧量相同
③苯乙烯和丁烯互为同系物④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数的值)
⑥![]() 分子中所有原子一定都在同一平面上
分子中所有原子一定都在同一平面上
A. ①②③B. ②④⑤⑥
C. ①②④D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是

A. M的分子式为C18H20O2
B. M可与NaOH溶液或NaHCO3溶液均能反应
C. 1 mol M最多能与7 mol H2发生加成反应
D. 1 mol M与饱和溴水混合,最多消耗5 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(l)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>___。基态K+电子占据最高能级的电子云轮廓图为___形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
a.离子键 b.氢键 c.![]() 键 d.
键 d.![]() 键
键
(3)BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为___,其中Be的配位数为___。
(4)第三周期元素氟化物的熔点如下表:
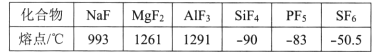
解释表中氟化物SiF4 、PF5、SF6熔点变化的原因:___。
(5)CaF2的一种晶胞如图所示。若r(F-)=xpm,r(Ca2+) =ypm,设阿伏加德罗常数的值为NA,则CaF2的密度![]() =___g·cm-3(列出计算表达式)。
=___g·cm-3(列出计算表达式)。
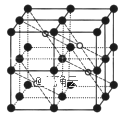
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备(NH4)2Fe(SO4)26H2O的实验中,需对过滤出产品的母液pH<1进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com