
【题目】(1)物质的量各为0.1mol钠、镁、铝单质,分别投入足量盐酸溶液中,生成相同条件下氢气的体积比为___。
(2)物质的量各为0.2mol的铝、铁、锌,分别与100ml1mol/L的硫酸溶液反应,生成相同条件下氢气的体积比为___。
(3)等质量的两份铝分别与足量的盐酸溶液和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量比为___。
【答案】1:2:3 1:1:1 3:1
【解析】
题中涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,④Fe+2HCl=FeCl2+H2↑,⑤2Al+2NaOH=2NaAlO2+3H2↑,根据各反应物的物质的量结合化学方程式计算。
题中涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,④Fe+2HCl=FeCl2+H2↑,⑤2Al+2NaOH=2NaAlO2+3H2↑。
(1)由反应方程式可知,分别取0.1mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比等于物质的量之比为![]() :1:
:1:![]() =1:2:3;
=1:2:3;
(2)100mL 1mol/L的盐酸的物质的量为0.1L×1mol/L=0.1mol,若将0.2mol金属铝、铁、锌分别投入到100mL 1mol/L的盐酸中,可知三种金属都过量,盐酸不足,完全反应,铝、铁、锌反应生成氢气一样多,生成相同条件下氢气的体积比为:1:1:1;
(3)通过化学方程式2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH=2NaAlO2+3H2↑可以看出,等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,金属是不足的,所以生成氢气的物质的量相等,所得H2的体积之比是:1:1。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
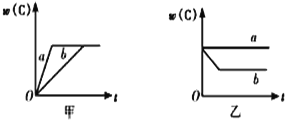
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则_____曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则____曲线表示恒温恒容的情况,且此时混合气体中w(C)____(填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是____(填“放热”或“吸热”)反应,x的值为____。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_____ (填序号)。
①w(C) ②A的转化率 ③压强 ④c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1 mol· L-1 H2C2O4的pH=1.3 ;0.1 mol· L-1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
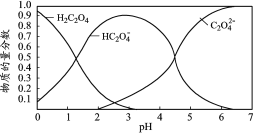
A.pH=4.5的草酸溶液中含有的大量微粒有:H2C2O4、HC2O4-、C2O42-
B.0.1 mol·L1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑ +8H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:2HC2O4- +Ca2++2OH-=Ca C2O4↓ +2H2O+C2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取某固体样品,进行如下实验:
①取a g样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊;
②取20mL溶液,加入足量氯水,无气体产生,再加入CCl4后分层,下层为橙红色;
③将②中溶液分液后,在上层溶液加入足量![]() 和盐酸,产生白色沉淀4.66g;
和盐酸,产生白色沉淀4.66g;
④另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体;
该固体样品可能是( )
A. NH4Cl NaBr (NH4)2SO4
B. CuBr2 NaCl (NH4)2SO3
C. NaBr Na2CO3 (NH4)2SO4
D. NaCl NaBr (NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
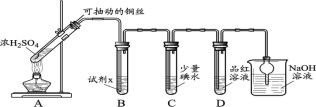
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
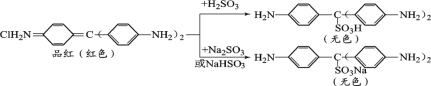
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 向澄清石灰水中通入足量二氧化碳:2OH+CO2===![]() +H2O
+H2O
B. 氧化钠投入水中发生反应:![]() +H2O===2OH
+H2O===2OH
C. 醋酸溶液滴入到NaOH溶液中:CH3COOH+OH===CH3COO+H2O
D. 铁和稀盐酸反应制氢气:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子团SCN化合价为-1价,在很多方面跟卤素原子相似,因此称为“拟卤素”。拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,又知氧化性I2>S,下列反应不正确的是( )
A. (SCN)2+2Br-=Br2+2SCN-
B. (SCN)2+H2S=2H++2SCN-+S↓
C. 4H++2SCN-+MnO2![]() Mn2++(SCN)2↑+2H2O
Mn2++(SCN)2↑+2H2O
D. (SCN)2+2I-=2SCN-+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成 NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质
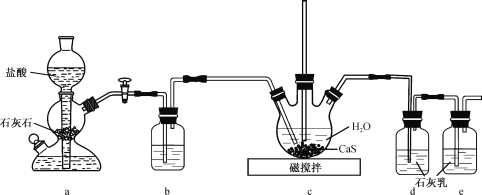
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ______________________________________;装置b中盛放的试剂是__________________ 。
②装置c中的长直导管的作用是____________________________________,三颈烧瓶中通入CO2 不能过量,原因是 ______________________________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________________________;该反应的化学方程式为___________________________________________________________________。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____________(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 __________________________________________________。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42— ,该反应中氧化剂与还原剂的物质的量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼矿主要含MoS2,还含有Ca、Si、Cu、Zn、Fe等元素。利用辉钼矿制备仲钼酸铵的新一代清洁生产工艺如下图所示:
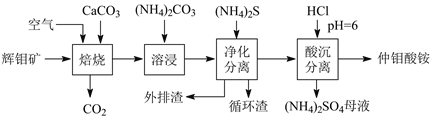
回答下列问题:
(1)焙烧温度为400℃,MoS2转化为CaMoO4和CaSO4,则反应中每摩MoS2转移的电子数为_________。仲钼酸铵(七钼酸铵)中的阴离子是Mo7O24n-,则n=_______。
(2)传统焙烧是在650℃下,使MoS2直接与空气中的O2反应生成MoO3和SO2。图示清洁生产工艺加入CaCO3的优点是______________。
(3)溶浸时,CaMoO4发生复分解反应的化学方程式是___________。循环渣的主要成分是CaCO3,则外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常温下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵(返回溶浸循环使用),原因是_______。
(5)电氧化分解钼精矿时,用惰性电极电解钼精矿和NaCl的混合浆液,电解槽无隔膜,控制溶液pH=9。阴极生成物为________,混合浆液中,阳极产物转化生成的NaClO氧化MoS2生成MoO42-和SO42-的离子方程式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com