
求下列常温条件下溶液的pH(已知lg1.3=0.1,lg2=0.3,混合溶液忽略体积的变化)。
(1)0.005 mol·L-1的H2SO4溶液
(2)0.1 mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度= ×100%)
×100%)
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合
(6)将pH=3的HCl与pH=3的H2SO4等体积混合
(7)0.001 mol·L-1的NaOH溶液
(8)pH=2的盐酸与等体积的水混合
(9)pH=2的盐酸加水稀释到1 000倍
答案 (1)2 (2)2.9 (3)11 (4)9.7 (5)6 (6)3
(7)11 (8)2.3 (9)5
解析 (2)CH3COOH CH3COO- + H+
c(初始) 0.1 0 0
c(电离) c(H+) c(H+) c(H+)
c(平衡) 0.1-c(H+) c(H+) c(H+)
则Ka= =1.8×10-5
=1.8×10-5
解得c(H+)=1.3×10-3 mol·L-1,
所以pH=-lg c(H+)=-lg(1.3×10-3)=2.9。
(3) NH3·H2O OH- + NH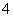
c(初始) 0.1 mol·L-1 0 0
c(电离) 0.1×1%mol·L-1 0.1×1%mol·L-1 0.1×1%mol·L-1
则c(OH-)=0.1×1% mol·L-1=10-3mol·L-1
c(H+)=10-11 mol·L-1,所以pH=11。
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液中c(H+)很明显可以根据pH来算,可以根据经验公式来求算pH=10-lg2(即0.3),所以答案为9.7。
(5)pH=5的盐酸溶液中c(H+)=10-5 mol·L-1,pH=9的氢氧化钠溶液中c(OH-)=10-5 mol·L-1,两者以体积比11∶9混合,则酸过量,混合液的pH小于7。
c(H+)=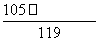 mol·L-1=1.0×10-6 mol·L-1,
mol·L-1=1.0×10-6 mol·L-1,
pH=-lg(1.0×10-6)=6。


科目:高中化学 来源: 题型:
用惰性电极电解100 mL 4 mol·L-1的CuSO4溶液,一定时间后在阳极收集到1.12 L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )
A.2.7 mol·L-1 B.3 mol·L-1
C.4 mol·L-1 D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:P4(g)+6Cl2(g)===4PCl3(g),
ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。
下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能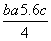 kJ·mol-1
kJ·mol-1
D.P—P键的键能为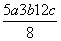 kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=+179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:


①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
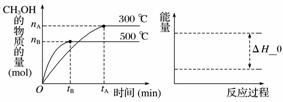
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)??CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)测定NaOH溶液浓度,可用滴定管、锥形瓶、烧杯、NaOH溶液、0.100 0 mol·L-1盐酸达到目的( )
(2014·安徽理综,9D)
(2)用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低( )
(2014·大纲全国卷,6D)
(3) ( )
( )
(2014·山东理综,10B)
(4)50 ℃时,pH=4的醋酸中,c(H+)=4.0 mol·L-1( )
(2013·广东理综,12A)
(5)50 ℃时,pH=12的纯碱溶液中,c(OH-)=1.0×10-2 mol·L-1( )
(2013·广东理综,12C)
(6)在蒸馏水中滴加浓硫酸,Kw不变( )
(2013·天津理综,5A)
(7)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
(2013·天津理综,5D)
(8)25 ℃与60 ℃时,水的pH相等( )
(2012·福建理综,10B)
(9)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
(10)用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和( )
(2012·浙江理综,12C)
(11)常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4( )
(2012·浙江理综,12A)
(12)“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用( )
(2011·浙江理综,8C)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关中和滴定的叙述正确的是( )
A.滴定时,标准液的浓度一定越小越好
B.用盐酸作标准液滴定NaOH溶液时,指示剂加入越多越好
C.滴定管在滴液前和滴液后均有气泡一定不会造成误差
D.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com