
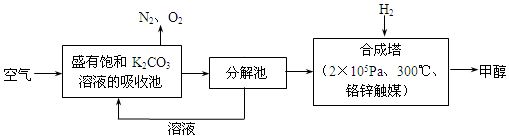

分析 空气中的CO2与K2CO3溶液生成KHCO3,碳酸氢钾不稳定,在分解池中加热分解生成碳酸钾和二氧化碳、水,二氧化碳与氢气合成甲醇,
(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3;
(2)1mol二氧化碳反应放出热量为5370kJ×$\frac{1mol×44g/mol}{4400g}$=53.7kJ,注明物质的聚集状态与反应热书写热化学方程式;
(3)减少大气中并产生清洁能源甲醇;可循环使用;能量可以循环利用,低碳经济等都体现了“绿色自由”构想中的“绿色”;
(4)①由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,故催化剂效果最佳的反应是反应Ⅰ;
②T3的b点时,反应未达到限度,故v(正)>v(逆);
③该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低.故T4的a点转化率比T5的c点高;
④c点时时,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):0.6 1.8 0 0
转化(mol/L):$0.6×\frac{2}{3}$ $0.6×\frac{2}{3}$$0.6×\frac{2}{3}$$0.6×\frac{2}{3}$
平衡(mol/L):0.2 0.6 0.4 0.4
带入平衡常数表达式计算;
(5)该装置中,根据电子流向知,M是负极,N是正极,正极得电子发生还原反应,反应式为CO2+2e-+2H+=CO+H2O.
解答 解:(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3;
故答案为:KHCO3;
(2)1mol二氧化碳反应放出热量为5370kJ×$\frac{1mol×44g/mol}{4400g}$=53.7kJ,该反应的热化学方程式为:CO2(g)+3H2(g)$\frac{\underline{\;2×105Pa,300℃\;}}{催化剂}$CH3OH(g)+H2O(g)△H=-53.7KJ/mol;
故答案为:CO2(g)+3H2(g)$\frac{\underline{\;2×105Pa,300℃\;}}{催化剂}$CH3OH(g)+H2O(g)△H=-53.7KJ/mol;
(3)减少大气中并产生清洁能源甲醇;可循环使用;能量可以循环利用,低碳经济等都体现了“绿色自由”构想中的“绿色”;
故答案为:减少大气中并产生清洁能源甲醇;可循环使用;能量可以循环利用,低碳经济等;
(4)①由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ;
故答案为:Ⅰ;
②T3的b点时,反应未达到限度,故v(正)>v(逆);
故答案为:>;
③该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低.T4的a点转化率比T5的c点高.
故答案为:该反应为放热反应,温度升高,平衡逆向移动;
④c点时,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):0.6 1.8 0 0
转化(mol/L):$0.6×\frac{2}{3}$ $0.6×\frac{2}{3}$$0.6×\frac{2}{3}$$0.6×\frac{2}{3}$
平衡(mol/L):0.2 0.6 0.4 0.4
在温度为T5时,该反应的平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.4×0.4}{0.2×0.{6}^{3}}$=3.70;
故答案为:K=3.70;
(5)该装置中,根据电子流向知,M是负极,N是正极,正极得电子发生还原反应,反应式为CO2+2e-+2H+=CO+H2O;
故答案为:CO2+2e-+2H+=CO+H2O.
点评 本题考查化学工业流程、热化学方程式书写、化学平衡计算与影响因素、电极反应式的书写等知识点,综合性较强,注意把握基础灵活运用,难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 6 | C. | 4 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制0.1mol•L-1氯化铝溶液 | 先将氯化铝晶体溶于浓盐酸中,后加蒸馏水稀释至指定体积 |
| B | 在加热条先下氢气还原氧化铜 | 反应完成后,先停止通入氢气,后停止加热 |
| C | 浓盐酸与碳酸钙反应制备CO2 | 气体产物先通过浓硫酸,后通过饱和碳酸氢钠溶液 |
| D | 检验某溶液是否含SO42- | 先加入BaCl2溶液,后加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
将溶质的质量分数为a%、物质的量浓度为c1 mol·L-1的稀硫酸加热蒸发掉一定量的水,使溶质的质量分数变为2a%,此时硫酸的物质的量浓度为c2 mol·L-1,则c1和c2的关系是( )
A.c2=2c1 B.c2>2c1 C.c2<2cl D.c1=2c2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| N2的体积分数 | w 1 | w 2 | w 3 |
| 混合气体的密度(g•L-1) | ?ρ1 | ?ρ2 | ?ρ3? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com