
| A. | 在化合物中呈+1价 | |
| B. | 常温下,单质能与水剧烈反应产生H2 | |
| C. | 氢氧化铯为强碱 | |
| D. | 铯元素的金属性比钠元素的弱 |
分析 铯是元素周期表中第六周期第ⅠA族元素,具有碱金属族元素,但其金属性大于碱金属族其它元素,
A.Cs最外层只有一个电子,在反应中易失去;
B.元素的金属性越强,其单质与水或酸反应越剧烈;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.同一主族元素,元素的金属性随着原子序数增大而增强.
解答 解:铯是元素周期表中第六周期第ⅠA族元素,具有碱金属族元素,但其金属性大于碱金属族其它元素,
A.Cs最外层只有一个电子,在反应中易失去,所以在化合物中Cs元素为+1价,故A正确;
B.元素的金属性越强,其单质与水或酸反应越剧烈,该元素金属性大于Na,钠与水反应较剧烈,则Cs与水反应更剧烈且生成氢气,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,该元素金属性大于Na,NaOH是强碱,则CsOH更是强碱,故C正确;
D.同一主族元素,元素的金属性随着原子序数增大而增强,所以金属性Cs>Na,故D错误;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一主族元素原子结构和性质相似性及递变性是解本题关键,会总结归纳并灵活运用元素周期律,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的结构式为 O-C-O | |
| B. | 氟化钠的电子式: | |
| C. | F原子的结构示意图: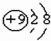 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
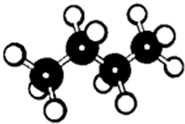 如图是一个分子的球棍模型图,图中大小“球”表示两种元素的原子,“棍”表示化学键.该模型表示的有机物是( )
如图是一个分子的球棍模型图,图中大小“球”表示两种元素的原子,“棍”表示化学键.该模型表示的有机物是( )| A. | 正丁烷 | B. | 正丁烯 | C. | 异丁烷 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 对于CaCO3(s)═CaO(s)+CO2(g) 任何温度下都不能自发进行 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
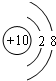 .
.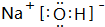 (填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).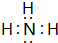 ,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱水洗涤油污 | |
| B. | 用食醋消除暖水瓶中的水垢 | |
| C. | 用碘水来检测成熟的苹果中是否含有淀粉 | |
| D. | 纤维素在人体内可水解为葡萄糖,故可作为人类的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO3- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | K+,Na+,Cl-,NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com