
| A. | 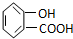 | B. | CH3CH2=CHCOOH | C. | 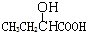 | D. | 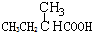 |
分析 -COOH、酚-OH具有酸性,-OH、-COOH可发生酯化反应,选项中与-OH相连C的邻位C上有H可发生消去反应,以此来解答.
解答 解:A.含-COOH具有酸性、可发生酯化反应,但不能发生消去反应,故A不选;
B.含-COOH具有酸性、可发生酯化反应,但不能发生消去反应,故B不选;
C.含-COOH具有酸性、可发生酯化反应,且与-OH相连C的邻位C上有H可发生消去反应,故C选;
D.含-COOH具有酸性、可发生酯化反应,但不能发生消去反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、醇性质的考查,注意消去反应的结构特点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
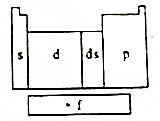 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.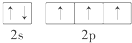 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: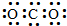 | B. | 乙烯的比例模型: | ||
| C. | 醋酸钠的分子式:C2H3O2Na | D. | C原子最外层电子的轨道表示式: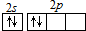 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以使用排水法收集氨气 | |
| B. | Na2O2既含有离子键,又含有非极性键 | |
| C. | 金属元素从游离态变为化合态一定被氧化 | |
| D. | Na2CO3饱和溶液中持续通入CO2气体有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 H2SO4 AlCl3 BaCl2 | B. | HCl NaOH K2SO4 NaHCO3 | ||
| C. | AlCl3 KHCO3 NaCl Na2SO4 | D. | NaOH FeCl3 MgCl2 K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化碳的化学式为C4N3 | |
| B. | 氮化碳的晶体类型为离子晶体 | |
| C. | 构成氮化碳晶体的微粒是碳原子和氮原子,且构成空间网状结构 | |
| D. | 氮化碳晶体中存在的微粒间的作用力有共价键和分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com