
【题目】下列物质中,既含有离子键,又含有共价键的是( )
A.H2O
B.CaCl2
C.NaOH
D.Cl2
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A.易形成-1价离子B.从上到下原子半径逐渐减小
C.最高价氧化物的水化物显酸性D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用流程如下:
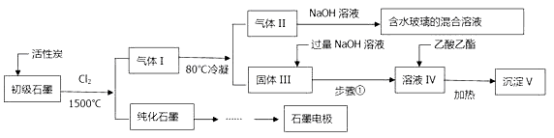
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)已知1mol石墨完全转化为金刚石需要吸收1.9kJ的能量。请写出石墨转化为金刚石的热化学反应方程式:
(2)向反应器中通入Cl2前,需通一段时间的N2。高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。80℃冷凝的目的是: 由活性炭得到气体Ⅱ的化学反应方程式为:
(3)加入过量NaOH溶液得到溶液IV的离子反应方程式为:
(4)用化学反应原理解释得到沉淀V的过程中乙酸乙酯和加热的作用: 。1kg初级石墨最多可获得V的质量为 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某卤代烃(R-X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却。正确操作的先后顺序是( )
A.③①⑤⑥②④B.③①②⑥④⑤
C.③⑤①⑥④②D.①③⑤⑥②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是( )
A.NaOH+HCl=NaCl+H2O
B.KOH+HNO3=KNO3+H2O
C.2NaOH+H2SO4=Na2SO4+2H2O
D.Ba(OH)2+H2SO4=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。
(1)配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。
A.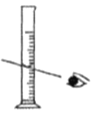 量取浓硫酸 B.
量取浓硫酸 B.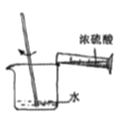 稀释浓硫酸 C.
稀释浓硫酸 C.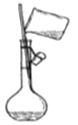 转移入容量瓶 D.
转移入容量瓶 D.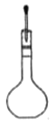 定容
定容
(2)浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:_______;当硫酸的浓度≥______mol/L时即具有脱水性。
(3)浓硫酸的强氧化性与浓度的关系
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
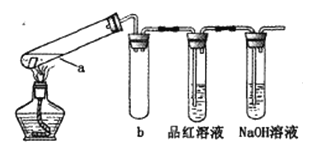
①b装置的作用是________
②本实验中证明浓硫酸具有强氧化性的现象是_________、________。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式____.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是_______.
(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作名称是_____,该操作用到的玻璃仪器是_____
A.烧杯 B.漏斗 C.酒精灯 D.玻璃棒
(2)固体X是_____(填化学式),溶液Y是_____(填化学式)
(3)步骤2中发生反应的离子方程式为 _____ 。
(4)将回收的铜和一定浓度的稀硫酸混合后在加热的情况下通入氧气,发生反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
(5)步骤4中涉及的操作是:蒸发浓缩、___________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com