
【题目】实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
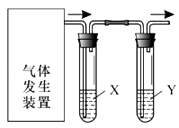
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是
( )
A.a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Ag+、Ca2+、NO3﹣、F﹣
C.c点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D.d点对应的溶液中:K+、NH4+、I﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 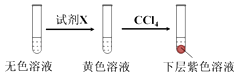
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业.某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探究.
【资料查阅】
【实验探究】
该小组用如图所示装置进行实验(夹持仪器略).
请回答下列问题:
(1)仪器X的名称是 .
(2)实验操作的先后顺序是a→→e(填操作的编号)
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 .
(4)装置D中发生的氧化还原反应的离子方程式是 .
(5)【探究反思】
反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2 , 则产生的原因是 .
②若杂质是CuO,则产生的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下:
(1)反应I:C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol﹣1 , 通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用: .
(2)反应II:CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1 . 如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系: .
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 .
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 .
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)△H1=﹣41kJmol﹣1
2H2(g)+O2(g)2H2O(g)△H2=﹣484kJmol﹣1
CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=﹣802kJmol﹣1
反应IV:CO(g)+3H2(g)CH4(g)+H2O(g)△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题. 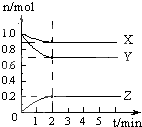
(1)反应开始至2min,Y的平均反应速率为;
(2)分析有关数据,写出X、Y、Z的反应方程式:;
(3)反应达到最大限度时,Y的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是
A. 利用了SO2的水溶性,将SO2直接通入水中
B. 利用了SO2的氧化性,将SO2直接通入水中
C. 利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D. 利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
卤素原子 | F | Cl | Br | I |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. FB. ClC. BrD. I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下面各题:
(1)向30毫升1mol/L的AlCl3溶液中逐渐加入浓度为2mol/L的NaOH溶液,若产生0.78克白色沉淀,则加入的NaOH溶液的体积可能为 .
(2)某溶液中有①NH4+、②Mg2+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 .
A.①②
B.②③
C.①③
D.③④
(3)把Ba(OH)2溶液滴入明矾溶液中,使SO42﹣全部转化成BaSO4沉淀,此时铝元素的主要存在形式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com