
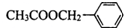 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: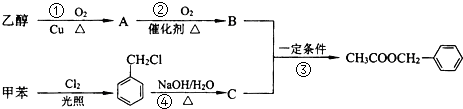
 +H2O$→_{△}^{氢氧化钠}$
+H2O$→_{△}^{氢氧化钠}$ +HCl;
+HCl;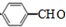 ;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式:
;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式: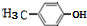
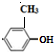 .
. 分析 乙醇在Cu或Ag催化作用下加热反应生成A为CH3CHO,CH3CHO继续被氧化成B为CH3COOH, 在碱性条件下水解生成C为
在碱性条件下水解生成C为 ,在一定条件下
,在一定条件下 与CH3COOH发生酯化反应生成
与CH3COOH发生酯化反应生成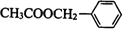 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:乙醇在Cu或Ag催化作用下加热反应生成A为CH3CHO,CH3CHO继续被氧化成B为CH3COOH, 在碱性条件下水解生成C为
在碱性条件下水解生成C为 ,在一定条件下
,在一定条件下 与CH3COOH发生酯化反应生成
与CH3COOH发生酯化反应生成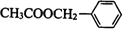 ,
,
(1)反应④为 的碱性水解,反应的方程式为:
的碱性水解,反应的方程式为: +H2O$→_{△}^{氢氧化钠}$
+H2O$→_{△}^{氢氧化钠}$ +HCl,
+HCl,
故答案为: +H2O$→_{△}^{氢氧化钠}$
+H2O$→_{△}^{氢氧化钠}$ +HCl;
+HCl;
(2)根据上面的分析可知,反应③的反应类型为取代反应,
故答案为:取代反应;
(3)根据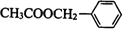 的结构可知,乙酸苯甲酯核磁共振氢谱中氢峰吸收面积之比为3:2:2:2:1,
的结构可知,乙酸苯甲酯核磁共振氢谱中氢峰吸收面积之比为3:2:2:2:1,
故答案为:3:2:2:2:1;
(4)C为 ,C在Cu/Ag存在下被O2氧化成醛的结构简式为
,C在Cu/Ag存在下被O2氧化成醛的结构简式为 ,根据条件:遇FeCl3溶液显紫色,说明有酚羟基,苯环上三氯代物有2种,则符合条件的C的同分异构体的结构简式为
,根据条件:遇FeCl3溶液显紫色,说明有酚羟基,苯环上三氯代物有2种,则符合条件的C的同分异构体的结构简式为 ,若苯环上一氯代物有4种,则符合条件的C的同分异构体的结构简式为
,若苯环上一氯代物有4种,则符合条件的C的同分异构体的结构简式为 ,
,
故答案为: ;
; ;
; .
.
点评 本题考查有机物的合成,题目难度中等,本题注意结合乙醇、氯代烃的性质进行推断,学习中注意相关知识的积累,本题难点为(4)中的同分异构体的书写.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
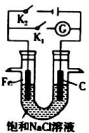 将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:
将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO>H2SO4>H2CO3; 非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF | |
| D. | 离子半径:Na+>Mg2+>Al3+>Cl-; 原子半径:Na>Mg>Al>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
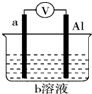 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1mol KClO3参加反应,转移的电子为1mol | |
| D. | H2C2O4的氧化性强于ClO2的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 80% | C. | 78.4% | D. | 21.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com