
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是 ( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、S2-
C. NH4+、Mg2+、SO42-、NO3- D. H+、K+、Cl-、Na+
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:
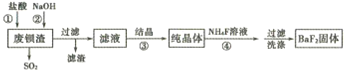
已知:Kap(BaS2O3)=6.96×10-11,Kap(BaF2)=1.0×10-6
(1)步骤①除产生SO2外,还有淡黄色固体生成,该反应的离子方程式为______________。
(2)步骤②的目的是中和过量的盐酸,加入NaOH溶液不宜过量,其原因是__________(用离子方程式表示)。
(3)滤液的主要成分是BaCl2,还含有少量NaCl,溶解度数据如下表:
温度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
NaCl | 36.0g | 36.6g | 37.3g | 39.0g | 39.8g |
BaCl2 | 35.8g | 40.8g | 46.2g | 52.5g | 59.4g |
步骤③宜采用_____ (填“蒸发结晶”或“降温结晶”)。
(4)工业上可用氨水吸收SO2,并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为__________。
(5)步骤④生成BaF2的反应类型为____________。
①若该反应温度过高,容易造成c(F-)降低的原因是__________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度,将浓度为0. 1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=__________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝的密度小,是一种轻金属
D.铝易被氧化,形成的氧化膜有保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列问题:
(1)该反应中被氧化的元素的名称为____,生成1 mol O2时转移电子的数目是________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称:________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为________。
(5)用双线桥法标明MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子或离子的电子排布式或排布图正确的是________(填序号,下同),违反能量最低原理的是____________,违反洪特规则的是________,违反泡利原理的是________。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:![]() ④Cr:1s22s22p63s23p63d44s2
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6⑦C:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(3分)下列与化学概念有关的说法正确的是( )
A. 化合反应均为氧化还原反应
B. 金属氧化物均为碱性氧化物
C. 催化剂能改变可逆反应达到平衡的时间
D. 石油是混合物,其分馏产品汽油为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
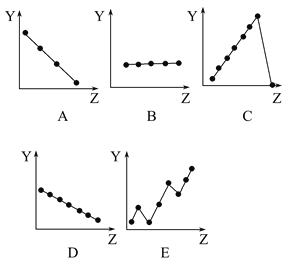
把与元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素原子的价电子数___________;
(2)第三周期元素的最高正化合价___________;
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___________;
(4)第二周期元素的原子半径(不包括稀有气体) ___________;
(5)第二周期元素的第一电离能 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:
![]()
在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
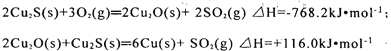
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:
![]()
下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
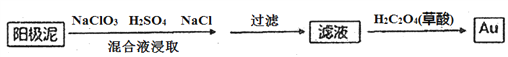
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com