
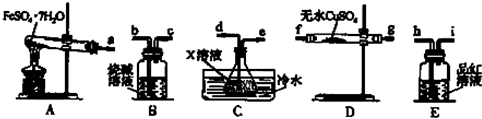
| A. | 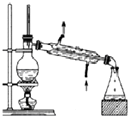 装置常用于分离互不相溶的液体混合物 装置常用于分离互不相溶的液体混合物 | |
| B. | 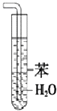 装置可用于吸收氨气,且能够防止倒吸 | |
| C. | 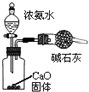 装置可用于制备少量NH3 | |
| D. | 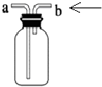 装置可用于收集O2 |
分析 A.互溶的液体采用蒸馏方法分离,互不相溶的液体采用分液方法分离;
B.有缓冲装置的能防止倒吸;
C.CaO和水反应生成氢氧化钙同时放出大量热,放出的热量促进一水合氨分解,碱石灰能干燥氨气;
D.氧气密度大于空气,应该采用向上排空气法收集.
解答 解:A.互溶的液体采用蒸馏方法分离,互不相溶的液体采用分液方法分离,所以该装置常用于分离互溶的液体混合物,故A错误;
B.有缓冲装置的能防止倒吸,该装置没有缓冲作用,不能防止倒吸,应该用四氯化碳,故B错误;
C.CaO和水反应生成氢氧化钙同时放出大量热,放出的热量促进一水合氨分解,碱石灰具有碱性,能吸收水分,所以能干燥氨气,故C正确;
D.氧气密度大于空气,应该采用向上排空气法收集,导气管遵循“长进短出”原则,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及气体收集、气体制备和干燥、尾气处理、物质分离和提纯等知识点,明确实验原理及物质性质是解本题关键,知道氨气制取方法及原理,易错选项是B.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
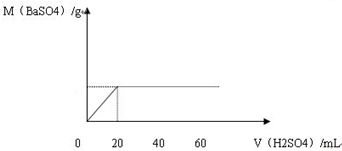
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、OH-、NO3- | B. | Mg2+、Na+、AlO2-、OH- | ||
| C. | Na+、Ba2+、OH-、SO42- | D. | Cu2+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -CHO的电子式: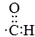 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式为:CH2CH2 | D. | 丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水的原理和家用消毒液消毒的原理相同 | |
| B. | 在食品中科学使用食品添加剂,有利于提高人类生活质量 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Cl-、NO3-、Fe3+ | |
| B. | 能使甲基橙显红色的溶液:CO32-、Na+、Cl-、SO42- | |
| C. | pH=1的溶液中:Mg2+、SO42-、Fe2+、Cu2+ | |
| D. | 能使铝钝化的溶液中:Ba2+、Na+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
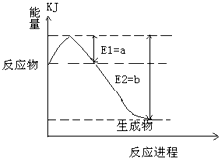 合成氨工业对国民经济和社会发展具有重要意义
合成氨工业对国民经济和社会发展具有重要意义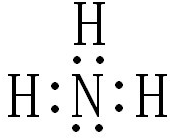
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com