
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
分析 ①根据纯净物和混合物的定义分析:纯净物中只含有一种物质,混合物中含有多种物质;
②金属氧化物可以是两性氧化物、酸性氧化物;
③根据冰和干冰的成分考虑,冰为水,干冰为二氧化碳;
④根据常见的合金铁合金、铜合金等分析,是两种或两种以上的金属融合在一起形成具有金属特性的混合物;
⑤盐酸是氯化氢气体的水溶液,食醋是醋酸的水溶液;
⑥纯碱不是碱而是显碱性的盐;
⑦分散质微粒直径在1nm-100nm,在分散剂中形成的分散系为胶体.
解答 解:①粗盐中含有氯化钠、氯化镁、氯化钙等物质,属于混合物;酸雨中含有亚硫酸和水等物质,属于混合物;故①正确;
②金属氧化物可以是两性氧化物如Al2O3,也可以是酸性氧化物如Mn2O7,故②错误;
③冰是固态的水,干冰是固态二氧化碳,所以它们既是纯净物又是化合物,故③正确;
④不锈钢是铁的合金,目前使用的硬币有铜镍合金和不锈钢,都属于合金,故④正确;
⑤盐酸中含有氯化氢和水属于混合物,食醋中含有乙酸和水属于混合物,故⑤错误;
⑥熟石灰是氢氧化钙是碱,纯碱是碳酸钠不是碱而是显碱性的盐,故⑥错误;
⑦豆浆是蛋白质水中形成的分散系,雾是由小水滴凝结灰尘而成的符合胶体分散质微粒直径,故⑦正确;
故选D.
点评 本题综合性的考查了与生活有关合金、酸雨、纯净物、混合物等多个知识点,难度不大,可依据化学知识和生活常识解答.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
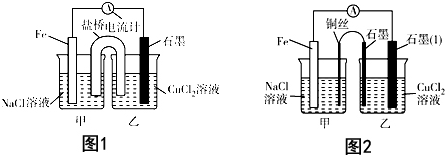

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.96L | B. | 4.48L | C. | 6.72L | D. | .3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是一种灰黑色、具有金属光泽、质地软的金属 | |
| B. | 氧化钠与过氧化钠的颜色不同 | |
| C. | 因为钠的性质非常活泼,故自然界中无游离态钠 | |
| D. | 过氧化钠可以做潜艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然皮革常用于制衣、制鞋、制胶,实际上它是凝固和变性的蛋白质 | |
| B. | 人体内不含水解纤维素的酶,故纤维素在人体内无任何作用 | |
| C. | 糯米中的淀粉一经水解,就酿成了酒 | |
| D. | 某品牌八宝粥不含糖类,糖尿病患者可放心食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
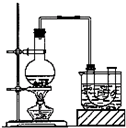 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、CH3COO- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2CO3的溶液:K+、Ca2+、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com